












1.4.1. Краткие теоретические сведения
Второе начало термодинамики – фундаментальный закон физики, определяющий направление протекания процессов. Этот закон был открыт и впервые сформулирован в связи с вопросом о работе тепловых двигателей.
Тепловой двигатель – устройство, с помощью которого энергия скрытой формы движения материи (энергия теплового движения) превращается в энергию механического движения.
Общие существенные черты всех тепловых машин состоят в следующем:
1. Тепловая машина работает циклами.
2. В течение цикла имеет место процесс (или ряд процессов) в результате которого рабочее вещество забирает от нагревателя некоторое количество теплоты Q1.
3. Имеет место процесс (или ряд процессов) в ходе которого холодильнику количество теплоты Q2 < Q1.
В соответствии с первым началом термодинамики работа машины A равняется балансу тепла:
![]() .
.
Величина 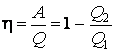 называется
термодинамическим коэффициентом полезного действия (КПД) тепловой машины.
называется
термодинамическим коэффициентом полезного действия (КПД) тепловой машины.
Термодинамический КПД идеальной тепловой машины Карно может быть выражен следующим образом:
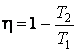 ,
,
где Т1 – температура нагревателя, Т2 – температура холодильника.
Второе начало термодинамики – это закон физики, запрещающий некомпенсированный переход тепла в работу, равно как и запрещающий некомпенсированную передачу тепла от тела более холодного к телу более горячему.
В
общей сложности насчитывается около 10 разных формулировок второго начала. Одна
из них связана с определением энтропии S: ![]() , где
, где ![]() –
тепло, сообщенное системе в элементарном квазистатическом переходе. Все
процессы в замкнутой системе протекают так, что энтропия ее не убывает:
–
тепло, сообщенное системе в элементарном квазистатическом переходе. Все
процессы в замкнутой системе протекают так, что энтропия ее не убывает: ![]() . Знак равенства относится к квазистатическим,
а неравенства – к нестатическим процессам. Введение энтропии позволяет первое и
второе начала записать в единой форме:
. Знак равенства относится к квазистатическим,
а неравенства – к нестатическим процессам. Введение энтропии позволяет первое и
второе начала записать в единой форме:
![]() .
(1.4.1)
.
(1.4.1)
Наряду с термодинамическим возможно и статистическое толкование энтропии:
![]() , где k
– постоянная Больцмана, W – термодинамическая вероятность.
, где k
– постоянная Больцмана, W – термодинамическая вероятность.
При решении задач термодинамики пользуются обычно двумя методами: методом циклов и методом характеристических функций. Метод циклов, в частности, приводит к уравнению Клапейрона-Клаузиуса, которое описывает фазовые переходы первого рода:
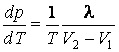 ,
(1.4.2)
,
(1.4.2)
где ![]() – теплота фазового перехода;
– теплота фазового перехода; ![]() – объемы, занимаемые фазами.
– объемы, занимаемые фазами.
Наиболее
употребительными характеристическими функциями (термодинамическими
потенциалами) являются внутренняя энергия ![]() ,
энтальпия
,
энтальпия ![]() , свободная энергия
, свободная энергия ![]() и функция Гиббса
и функция Гиббса ![]() . С помощью термодинамических
потенциалов можно выразить параметры состояния системы:
. С помощью термодинамических
потенциалов можно выразить параметры состояния системы:
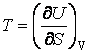 ;
; 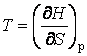
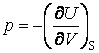 ;
; 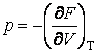
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.