



Способы индикации конечных точек титрования КТТ
1. Метод Мора
2. Метод Фольгарда
3. Метод Фаянса
![]() 1. Метод
прямого титрования, применяется в первую очередь для определения ионов Cl - и Br -. pH 7-10 (один из недостатков метода это его узкий
интервал pH). Титрование производится стандартным раствором AgNO3. Этим методом можно также
определять ионы Ag+ (например,
с помощью стандартного раствора NaCl).
1. Метод
прямого титрования, применяется в первую очередь для определения ионов Cl - и Br -. pH 7-10 (один из недостатков метода это его узкий
интервал pH). Титрование производится стандартным раствором AgNO3. Этим методом можно также
определять ионы Ag+ (например,
с помощью стандартного раствора NaCl).
Индикатор: K2CrO4, в точке эквивалентности образует соединение Ag2CrO4
![]()
![]()
![]() При титровании в растворе происходит реакция: Ag+ + Cl - AgCl как только ионы Cl – израсходуются и появится избыток Ag+ появится красный осадок, это и будет конечной точкой
титрования 2 Ag+ + CrO4- Ag2CrO4. Для получения хорошего результата, необходимо
правильно выбрать концентрацию хромат ионов.
При титровании в растворе происходит реакция: Ag+ + Cl - AgCl как только ионы Cl – израсходуются и появится избыток Ag+ появится красный осадок, это и будет конечной точкой
титрования 2 Ag+ + CrO4- Ag2CrO4. Для получения хорошего результата, необходимо
правильно выбрать концентрацию хромат ионов.
ПР(AgCl)=10-10
ПР(Ag2CrO4)=10-12
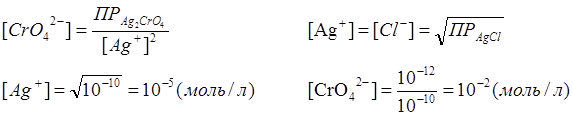
При иной концентрации изменится pH осадка:
![]()
![]()
![]() pH<7: CrO42-
HCrO4- - разрушение,
растворение осадка
pH<7: CrO42-
HCrO4- - разрушение,
растворение осадка
![]() pH>10: Ag+
+ OH- AgOH , либо Ag2O
pH>10: Ag+
+ OH- AgOH , либо Ag2O
Недостатки метода: узкий интервал pH. Невозможно использовать окрашенные растворы. Ионы I- и SCN- адсорбируют в точке эквивалентности => их трудно точно определить. Катионы, которые осаждаются с хромат ионом (Ba2+, Pb2+, Bi2+) дают дополнительную ошибку. Также мешают анионы, осаждающиеся с серебром (фосфат, аксолат ионы).
Достоинства метода: прямое титрование позволяет легко определить Ag+ и Cl – ионы
2. Используется для определения Cl – в кислой среде. Это метод обратного титрования (используется два стандартных раствора).
1-й стандарт: AgNO3, избыток
![]()
![]() Ag+изб
+ Cl - AgCl (белый рыхлый (творожестый осадок)
Ag+изб
+ Cl - AgCl (белый рыхлый (творожестый осадок)
![]()
![]() Ag+остаток + SCN- AgSCN
(белый осадок)
Ag+остаток + SCN- AgSCN
(белый осадок)
2-й стандарт (KSCN или NH4SCN)
ПРAgCl≡ks=10-10
ПРAgSCN≡ks=10-12
Метод может использоваться для определения Ag+
![]()
![]() Ag+ + SCN-
AgSCN - прямое титрование относительно Ag+
Ag+ + SCN-
AgSCN - прямое титрование относительно Ag+
Фиксирование конечной точки титрования: аммонийные квсцы: NH4Fe(SO4)2*12H2O
![]() Fe3+ + SCN-минимильный
изб-к [FeSCN]2+-
кроваво-красная комплексная соль
Fe3+ + SCN-минимильный
изб-к [FeSCN]2+-
кроваво-красная комплексная соль
![]() побочная реакция: (*) AgCl + [FeSCN]2- AgSCNбелый + Cl - + Fe3+
побочная реакция: (*) AgCl + [FeSCN]2- AgSCNбелый + Cl - + Fe3+
sAgCl>sAgSCN следовательно, титрование должно вестись быстро, пока не пошла побочная реакция (*).
Недостатки метода: капризный метод. Для стабилизации конечной точки эквивалентности иногда используют органические растворители.
Достоинства: позволяет работать в кислой среде. Ионы, которые мешают в методе Мора, здесь не влияют на точность результата.
3. Используются адсорбционные индикаторы. Адсорбируясь (оседая) на поверхности осадка в точке эквивалентности, эти индикаторы меняют свою окраску зелёный – красный (флуоросцеин, обозначается: ф-ф; Ф).
![]()
![]() Ag+
+ Cl -
AgCl до точки эквивалентности Cl - - в избытке
Ag+
+ Cl -
AgCl до точки эквивалентности Cl - - в избытке
![]() AgCl-Cl -
- происходит адсорбирование
AgCl-Cl -
- происходит адсорбирование
Na+ + Ф- зелёный
В точке эквивалентности: Ag+ - избыток
![]() AgCl·Ag+
NO3- + Ф-
AgCl·Ag+
NO3- + Ф-
Далее:
![]() AgCl·Ag+ NO3- + Ф-
AgCl·Ag+ NO3- + Ф-
AgCl Ag+ Ф- красный
Недостатки: повышается ошибка титрования за счёт создания избытка титранта на избыточную концентрацию Ag+. Необходим холостой опыт, а после этого находят разницу холостого и рабочего опытов.
13.11.2001
Это метод количественного определения веществ, основанные на реакциях окисления и восстановления. Характерная особенность этих реакций - это переход электронов между реагентами.
Компонент + e- - окислитель, восстанавливается, z (заряд) уменьшается.
Компонент - e- - восстановитель, окисляется, z (заряд) возрастает.
![]()
![]()
![]() a ox1 + be- red1
a ox1 + be- red1
![]()
![]() b ox2 + ae- red2
b ox2 + ae- red2
![]()
![]() a ox1 + b red2 a red1
+ b ox2 (3)
a ox1 + b red2 a red1
+ b ox2 (3)
пары: ox/red – окислительно-восстановительная пара.
[E0]=[В]=[вольт] – стандартный окислительно-восстановительный потенциал, даёт количественную оценку свойств окислительно-восстановительных пар (справочник).
Знак потенциала соответствует следующей полуреакции:
![]()
![]() ox + n e-
red (4)
ox + n e-
red (4)
Измерение E0: составляется гальванический элемент (стандартный водородный электрод и электрод, на котором протекает интересующая нас полуреакция в стандартных условиях).

Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.