













Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Рыбинская государственная авиационная технологическая
академия им. П.А. Соловьева
КАФЕДРА ОБЩЕЙ И ТЕХНИЧЕСКОЙ ФИЗИКИ
на заседании методического
семинара кафедры физики
« » _________ 2005 г.
Зав.каф. Пиралишвили Ш.А.
ЛАБОРАТОРНАЯ РАБОТА № КФ – 3
ИЗУЧЕНИЕ МОЛЕКУЛЯРНЫХ СПЕКТРОВ
ПОГЛОЩЕНИЯ ПРИ ПОМОЩИ ФОТОМЕТРА ФМ – 58
|
Нормоконтролёр |
Автор: к. ф–м. н., доцент Шалагина Е.В |
|
____________ |
___________________ |
|
Рецензент: к. ф–м. н., доцент Шувалов В.В. |
|
|
___________________ |
Работа выполняется в соответствии с общими требованиями техники безопасности, действующими в учебных лабораториях кафедры физики.
ЦЕЛЬ РАБОТЫ: Получение и анализ молекулярных спектров поглощения в области 400-750 нм визуальным методом.
ПРИБОРЫ И ОБОРУДОВАНИЕ: Фотометр ФМ-58, питающее устройство, кювета с дистиллированной водой и исследуемым раствором.
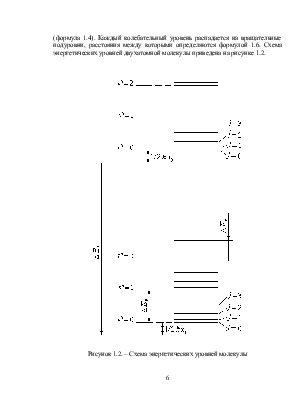
Молекулярные спектры при наблюдении в прибор средней разрешающей силы состоят из полос, резких с одного края и размытых – с другого. Такие полосы лежат в близкой инфракрасной, видимой и ультрафиолетовой частях спектра. Полосы образуют серии полос: отдельные полосы и даже серии полос могут перекрывать друг друга. При использовании приборов высокой разрешающей силы каждая полоса в молекулярном спектре распадается на совокупность близко расположенных линий. Сложность полосатых молекулярных спектров по сравнению с линейчатыми спектрами атомов обусловлена более сложной структурой молекул, что приводит к расщеплению энергетических уровней валентных электронов.
Силы, удерживающие атом
в молекуле, вызваны взаимодействием внешних электронов. В случае двухатомных
молекул различают два вида связи: ионную (гетерогенную) и ковалентную (атомную,
гомеополярную). Ионная связь осуществляется, когда электроны в молекуле можно
разделить на две группы, каждая из которых все время находится около одного из
ядер. Электроны распределяются так, что около одного из ядер образуется избыток
электронов, около другого – недостаток. Таким образом, молекула как бы состоит
из ионов противоположных знаков, взаимодействующих по закону Кулона. Примером
молекул с ионной связью служат молекулы соединений щелочных металлов с
галогенами (![]() ) и др. При растворение таких соединений
в воде, молекулы распадаются на ионы.
) и др. При растворение таких соединений
в воде, молекулы распадаются на ионы.
Ковалентная связь наблюдается
в молекулах, у которых часть электронов обобществляется двумя ядрами. Эта связь
образуется парами электронов с противоположно направленными спинами и вызвана
добавочным обменным взаимодействием электронов. Среди молекул этого типа
следует различать молекулы с одинаковыми ядрами (![]() )
и молекулы с различными ядрами (
)
и молекулы с различными ядрами (![]() ) и др. В
молекулах первого рода электроны распределены симметрично, в молекулах второго
рода существует асимметрия в распределении электронов. Благодаря чему молекулы
приобретают электрический дипольный момент.
) и др. В
молекулах первого рода электроны распределены симметрично, в молекулах второго
рода существует асимметрия в распределении электронов. Благодаря чему молекулы
приобретают электрический дипольный момент.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.