







Разбавленные водные растворы органических соединений
При радиолизе водных растворов органических веществ, в результате косвенного действия ИИ образуется, как правило, большой набор трудно идентифицируемых продуктов, что осложняет изучение механизмов протекающих при этом процессов. Поэтому мы остановимся только на относительно хорошо изученных систем.
Водные растворы алифатических спиртов
Спирты в водных растворах быстро реагируют с радикалами ОН· и О— . Константы скоростей реакций к порядка 108 – 109 л/моль.с.
Гидратированные электроны взаимодействуют с ними гораздо медленнее. Основным каналом их превращения является реакция (1):
е-aq+ Н+→ Н· (1)
В присутствии кислорода – добавляется реакция (2) -
О2 + Н· → НО2· (2)
Кроме этого, в рассматриваемых растворах, е-aq могут реагировать с перекисью водорода и с карбонильными соединениями, являющимися продуктами радиолиза спиртов, но это уже т.н. «вторичный» радиолиз.
Радикалы НО2· и О2·— практические нереакционноспособны по отношению к спиртам. Т.о. основным источником продуктов радиолиза оказываются реакции гидроксильных радикалов с органическими молекулами.
Радикалы ОН· и Н· отрывают от них атом водорода, преимущественно разрывая связь С-Н в α-положении к спиртовой группе. При этом образуются α-гидроксиалкильные СР. Не вдаваясь в подробности, их свойства сводятся к следующему: λмакс≤ 250 нм, ε = 102 – 103 л/моль.см; 2К = 107- 109 л/моль.с;
РКа = 10 – 12.
Кроме α-гидроксиалкильных СР, при взаимодействии ОН· и Н· со спиртовой молекулой образуются также спиртовые СР с другой локализацией неспаренного электрона, в частности, в небольших количествах возникают алкоксильные СР - RO·, однако последние быстро переходят либо в α-гидроксиалкильных СР, отрывая атом водорода от соседней неповрежденной молекулы спирта
(реакция 3)
либо претерпевая внутрирадикальную деструкцию (реакции 4, 5):
R-СН2О· + R-СН2ОН → R-СН2ОН + R-·СНОН (3)
R-СН2О· → R· + СН3ОН (4)или R-СН2О· → R· + СН2О (5)
В результате протекания реакций между этими реакционными частицами образуются диолы и карбонильные соединения. Соотношения их РХВ существенно зависит от природы реагентов и условий проведения эксперимента.
В случае образования метильного СР – преобладает процесс димеризации, для разветвленных спиртов – процесс диспропорционирования.
В присутствии кислорода с большей скоростью образуются перекисные радикалы, склонные к элиминированию гидроперекисного СР, приводящей к образованию карбонильных производных (альдегидов и кетонов) (реакции 6).
R-С·НОН + О2 → R-ОНСНОО· → НО·2 + R-СНО (6)
Кроме того, перекисные радикалы являются источником образования алкил-перекисных, гидроперекисных соединений, а радикалы НО2· - перекиси водорода. О том как их раздельно регистрировать мы с вами рассуждали в курсе «Методы…»
Водные растворы карбонильных соединений
КС – эффективные акцепторы гидратированных электронов. В результате образуются α-гидроксиалкильные СР:
СН3СНО + е-aq → СН3·СНО –
СН3·СНО -- + Н2О↔ СН3·СНОН + ОН –
Одно из исключений составляет формальдегид, который в воде существует в гидратированной форме:
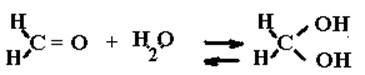
Поэтому он, как и спирты реагирует с е-aq медленно (или вообще не реагирует).
Для других альдегидов это явление выражено менее сильно.
В случаях же с кетонами, такая гидратация вовсе нехарактерна.
Гликолевый альдегид – простейший оксиальдегид формулы НОСН2СНО.
При радиолизе его дезаэрированных водных растворов (0,1 М, рН=7) обнаружены следующие продукты: ацетальдегид, уксусная кислота, водород, метанол, и окись углерода с РХВ – 1,7, 12, 0,87, ‹ 1, и 0,21, соответственно. Постулировано, что образование уксусной кислоты происходит в результате реакций Н· и ОН· радикалов с гидратированной формой гликолевого альдегида, последующего распада радикалов НОСН2·С(ОН)2 на ·СН2СООН и Н2О, взаимодействия дегидратированного ·СН2СООН с гликолевым альдегидом.. Почему так сложно? Потому, что нужно объяснять цепной процесс образования уксусной кислоты, ведь ее РХВ явно превышает РХВ разложения воды.
Радиолиз ацетона достаточно подробно изложен у А.К. Пикаева.
Водные растворы алифатических кислот
Гидратированный электрон весьма эффективно взаимодействует с недиссоциированными кислотами (к ≈ 108 л/моль.с), но с анионами эта реакция затруднена в силу кулоновского расталкивания.
Прослеживаются 2 основных реакционных канала:
СН3СООН + е-aq → СН3СОО-- + Н· и
СН3СООН + е-aq → СН3СО· + ОН aq –
Радикалы Н* и ОН* реагируют с кислотами, отрывая атом водорода:
СН3СООН + Н· → ·СН2СООН + Н2
СН3СООН + ОН· → ·СН2СООН + Н2О
Если алкильная группа кислоты содержит два и более атомов углерода, то возможно образование радикалов нескольких типов.
Например, в случае с пропионовой кислотой образуются СР:
·СН2 СН2СООН и СН3·СН2СООН
Реакции с ОН-радикалами – сравнительно быстрые, причем анионы взаимодействуют несколько быстрее, чем недиссоциированные формы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.