


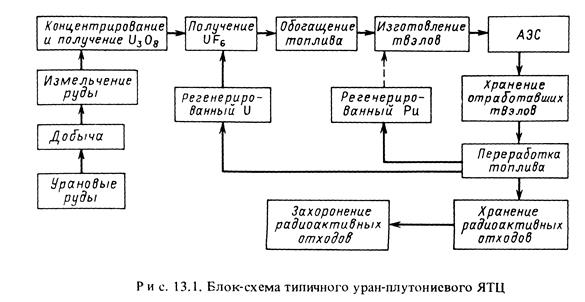
12.2 Начальная стадия ТЭЦ : добыча и переработка руды
Уран — широко распространенный элемент, находящийся в природных соединениях в о кисной форме.
Мировые запасы оцениваются 5 - 11 млн. тонн. Российские запасы - несколько сотен тысяч тонн. Например, разведанные запасы Стрельцовского рудного поля (Читинская обл.), составляют ~170 тыс. тонн, запасы Витимского ураново-рудного района (Баунтовский район Бурятии) - ~150 тыс.тонн.
Однако на Земле очень мало районов, где он залегает в концентрациях(больше 0,1%), при которых его экономически целесообразно добывать. Основные месторождения урана находятся в Австралии, Канаде, Южной Африке, Казахстане и на Западе США.
Богатые руды могут содержать до 4% урана (см. табл. 12.1), в Канаде существуют руды с содержанием урана до 23%. Кроме значительного количества урана, содержащегося в земной коре (около 4 • 109 т), уран содержится в океанских водах. Однако концентрация урана "в этих водах очень низка, порядка 3 • 10-9, так что его добыча из воды станет экономически целесообразной только тогда, когда большая часть ресурсов урановых руд будет исчерпана.
|
Форма нахождения |
Содержание урана, % |
|
Изверженные породы: |
|
|
базальты |
6 · 10-5 |
|
граниты (нормальные) |
4,8 · 10-4 |
|
ультраосновные породы |
3 · 10-6 |
|
Песчаники, сланцы, известняки |
(1,2÷1,3)· 10-4 |
|
Земная кора |
2,1 · 10-4 |
|
океаническая |
6,4· 10-5 |
|
континентальная |
2,8 · 10-4 |
|
Мантия Земли |
~ 1 · 10-6 |
|
Морская вода |
(2÷З) · 10-7 |
|
Метеориты |
5 · 10-6 |
|
хондриты |
1,1 · 10-6 |
|
Ураноносные материалы: |
|
|
богатые жилы |
30-85 |
|
жильные руды |
0,2-1 |
|
песчанистые руды |
0,05-0,4 |
|
золотоносные конгломераты (ЮАР) |
(1,5÷6) – 10-2 |
|
ураноносные фосфаты |
(0,5÷3) · 10-2 |
|
сланцы Чаттануги (США) |
6 · 10-3 |
|
ураноносные граниты |
(0,15÷1) · 10-2 |
Табл . 12.2.1 Распространенность урана в природе
12.2.1 Добыча урана и переработка руды
Добыча урана
Из трех используемых способов добычи урана два являются традиционными для горно-добывающей промышленности:
подземный (шахтный) может быть использован при наличии выраженных рудных жил в крепких горных породах (в России – месторождения Стрельцовского рудного поля), недостаток метода - необходимость наличия наземных хранилищ рудных отвалов и выделение радона;
открытый (карьерный) - может применяться лишь для небольших глубин залегания руды (до 500м) (в России сегодня не используется).
Третий - метод подземного выщелачивания (используется с 60-х годов 20 века), считающийся наиболее экологически чистым, основан на заполнении рудных пород растворяющими уран химическими реагентами и откачке ураносодержащих растворов на поверхность. Условия применения метода - минерализация урана в пористых породах, расположенных между водонепроницаемыми слоями. В России этот метод используется при добыче руды на урановых месторождениях «Хиагда» (с. Романовка, Баунтовский район Бурятии) и «Далур» на Далматовском месторождении в Курганской области.
Переработка руды
В промышленной технологии извлечения урана из руд используется свойство растворимости окислов урана в водных растворах азотной, серной и соляной кислот, а также в щелочных растворах. Практически в жидкий раствор можно перевести весь уран. Технологические процессы перевода и концентрирования металлов, содержащихся в измельченной рудной массе, в растворы (выщелачивание) и последующее селективное извлечение металлов из этих растворов называются гидрометаллургическими процессами.
На рисунке 12.2.1 приведена схема основных стадий получения чистых соединений урана в процессе переработки урановых руд.

Рис. 12.2.1 схема основных стадий переработки урановых руд для получения химических концентратов урана и чистых соединений урана
Первой стадией является (обогащение) урановой руды. Для этого используются физические методы: с последующим химическим извлечение урана из рудного концентрата; и химические методы (выщелачивание, чтобы перевести уран в шестивалентное состояние - такие соединения имеют большую растворимость).
Растворенный уран, извлекается из щелочного раствора методом экстракции или ионообмена. Полученный таким образом продукт, называемый "желтым пеком", содержит 70-80% окислов урана в виде смеси U02 и U308.
Так, Приаргунское горно-химическое объединение (г. Краснокамск Читинской обл.), базирующееся на Стрельцовском рудном поле (разведанные запасы 170 тыс. тонн) производит в год 3 тыс. тонн такого урана.
12.2.2 Получение соединений урана для изготовления топлива или для процесса обогащения.
Изготовление твэлов с естественным или обогащенным ураном в металлической или окисной форме требует в качестве промежуточной стадии получения чистой двуокиси урана U02. Она получается восстановлением водородом из концентрата окислов: U308 + 2Н2 ª 3U02 + 2Н20.
Двуокись урана можно получить другим способом, растворяя урановый концентрат в азотной кислоте. Этот раствор поступает в экстракционную колонну, в которой образуется гексагидрат уранилнитрата. Это соединение при нагревании разлагается до триоксида урана U03 ("оранжевый оксид"). При взаимодействии U03 с водородом он восстанавливается до U02. При достаточной химической чистоте последнего из него можно непосредственно изготовить твэлы из оксида естественного урана.
Для конверсии в металлический уран или в промежуточный продукт, поступающий на обогатительные заводы, U02 превращается в тетрафторид урана UF4 в результате реакции с безводным фтористым водородом:
U02 + 4HF ª UF4 + 2Н20.
Чистый металлический уран можно получить из UF4, восстанавливая его кальцием или магнием. Например,
UF4 + 2Mg ª 2MgF2 + U.
Большая разность плотностей жидкого металла и расплавленного шлака позволяет легко отделить их друг от друга.
Если уран нужно обогатить по изотопу 235U, то его предварительно превращают в гексафторид урана UF6, который переходит в газовую фазу при температуре выше 60 °С. Такая конверсия осуществляется реакцией с фтором:
UF4 + F2 ª UF6.
После обогащения гексафторид урана вновь восстанавливают до UF4:
UF6 + H2 ª UF4 + 2HF.
Затем UF4 может быть восстановлен до металлического урана магнием или кальцием, как уже описывалось выше, или конвертирован в U03 при взаимодействии с водными растворами щелочей. Последнее соединение конвертируется при взаимодействии с водородом в обогащенную по 235U двуокись U02, из которой изготавливаются твэлы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.