





















7. ИОННЫЕ СВОЙСТВА СВЯЗИ
7.1. Оценка ионного характера связи.
Если квантово-механические расчёты ковалентной составляющей в полной волновой функции дают довольно хорошие результаты, то теоретически рассчитать степень ионности связи практически невозможно. Поэтому оценку ионного характера связи производят исходя из экспериментальных данных, а именно, из значения дипольного момента связи. Как известно, диполь представляет собой два связанных между собой разноимённых заряда на определённом расстоянии друг от друга. Учитывая, что молекул со 100 % ионной связью в природе не существует, дипольный момент, имеющий размерность единица заряда умноженная на расстояние, может быть представлен по-разному. В одном случае берут целочисленный (неделимый) заряд, а расстояние между зарядами приходится брать меньше, чем расстояние между атомами. В другом случае расстояние между зарядами принимают равным расстоянию между атомами, но заряд принимают равным доле истинного заряда (доле ионного характера связи).
Экспериментально значения дипольных моментов определяют из опытов по эффекту Штарка в молекулярной спектроскопии и по измерению диэлектрической проницаемости растворов. В системе СИ единицей измерения дипольного момента является Кл×м. Внесистемная единица дипольного момента - Дебай. 1 Д = 3.3×10-30 Кл×м. В системе CGS 1 Д = 10-18.
Зная значение дипольного момента m, вычисленного из экспериментальных данных, можно определить степень ионности связи, если известна из функциональная взаимозависимость. Такая зависимость находится следующим образом.
Если среднее смещение центра тяжести двух валентных электронов связи обозначить rсм, то дипольный момент определяется выражением
![]() .
(7.1)
.
(7.1)
![]() ,
,
где
![]() ,
, ![]() ,
,  ,
, ![]() .
Пропуская промежуточные преобразования, запишем окончательный результат для
степени ионного характера связи Р:
.
Пропуская промежуточные преобразования, запишем окончательный результат для
степени ионного характера связи Р:
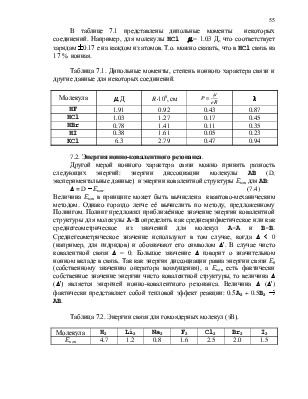
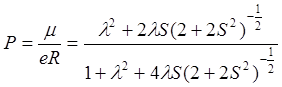 .
(7.2)
.
(7.2)
Для грубого расчёта можно принять S » 0. Тогда выражение 7.2 примет вид:
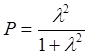 .
(7.3)
.
(7.3)
В таблице 7.1 представлены дипольные моменты некоторых соединений. Например, для молекулы HCl m= 1.03 Д, что соответствует зарядам ± 0.17 е на каждом из атомов. Т.о. можно сказать, что в HCl связь на 17 % ионная.
Таблица 7.1. Дипольные моменты, степень ионного характера связи и другие данные для некоторых соединений.
|
Молекула |
m, Д |
R×108, см |
|
l |
HF |
1.91 |
0.92 |
0.43 |
0.87 |
|
HCl |
1.03 |
1.27 |
0.17 |
0.45 |
|
HBr |
0.78 |
1.41 |
0.11 |
0.35 |
|
HI |
0.38 |
1.61 |
0.05 |
0.23 |
|
KCl |
6.3 |
2.79 |
0.47 |
0.94 |
7.2. Энергия ионно-ковалентного резонанса.
Другой мерой ионного характера связи можно принять разность следующих энергий: энергии диссоциации молекулы АВ (D, экспериментальные данные) и энергии ковалентной структуры Еков для АВ:
D = D - Еков. (7.4)
Величина Еков в принципе может быть вычислена квантово-механическим методом. Однако гораздо легче её вычислить по методу, предложенному Полингом. Полинг предложил приближённое значение энергии ковалентной структуры для молекулы А-В определять как среднеарифметическое или как среднегеометрическое из значений для молекул А-А и В-В. Среднегеометрическое значение используют в том случае, когда D < 0 (например, для гидридов) и обозначают его символом D¢. В случае чисто ковалентной связи D = 0. Большое значение D говорит о значительном ионном вкладе в связь. Так как энергия диссоциации равна энергии связи Е0 (собственному значению оператора возмущения), а Еков есть фактически собственное значение энергии чисто ковалентной структуры, то величина D (D¢) является энергией ионно-ковалентного резонанса. Величина D (D¢) фактически представляет собой тепловой эффект реакции: 0.5А2 + 0.5В2 ® АВ.
Таблица 7.2. Энергии связи для гомоядерных молекул (эВ).
Молекула |
H2 |
Li2 |
Na2 |
F2 |
Cl2 |
Br2 |
I2 |
|
Еков |
4.7 |
1.2 |
0.8 |
1.6 |
2.5 |
2.0 |
1.5 |
Так как зависимость D (D¢) от природы соединения АВ аналогична соответствующему изменению l, то величину D (D¢) также можно использовать в качестве меры ионного характера связи (см. табл.7.3).
Таблица 7.3. Энергия связи (эксперимент), Еков, D, и l для гетерогенных соединений.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.