

1. Цель работы- проведение оценки выхода кремния во время технологического процесса выращивания кремниевой плёнки и приобретение практических навыков в проведении технологических расчётов.
2.Теоретическое обоснование.
![]() Используется реакция
термического восстановления тетрахлорида кремния в атмосфере водорода : SiCl4 +2H2
= Si+4HCl (
1 )
Используется реакция
термического восстановления тетрахлорида кремния в атмосфере водорода : SiCl4 +2H2
= Si+4HCl (
1 )
Реакция происходит на поверхности кремниевых подложек и на самой цилиндрической подставке (ее верхняя торцевая плоскость и боковая поверхность), нагретых до температуры 1100- 1250 о С. Предполагается, что реакция практически не происходит на нижней торцевой плоскости и на стенках реактора, а непрореагировавший тетрахлорид и продукты реакции уносятся потоком газа носителя. Более подробно реакция и особенности ее проведения описаны в методически указаниях [ 1 ].
Выход кремния можно оценить как отношение массы кремния осажденного на поверхность подставки к общему содержанию кремния в парогазовой смеси (ПГС), прошедшей через реактор за время процесса. Обозначим их соответственно Р1 и Р2 .
.Введём некоторые обозначения и расчётные соотношения.
Исходные технологические параметры, используемые при расчётах:
V- скорость осаждения пленки, [мкм/мин] - определяется экспериментально, зависит от режима и конструкции установки;
Q- общий расход ПГС, [л/час ]- задано;
q- расход SiCl4, [л/час ]; q= Q . C , где С- объёмная концентрация SiCl4 в ПГС;
tn - длительность процесса выращивания пленки, [мин], определяется толщиной и скоростью выращивания V . Для удобства последующих расчётов следует перевести все характеристики к единым единицам: см, см2, см3, см/мин, см3/мин.
Тогда Q' = 16,7 Q - общий расход ПГС, [см3/мин]
V' = 10-4. V - скорость,[см/мин];
q' = 16,7 q = 16,7 Q . C - расход SiCl4 [см3/мин](объём 1 моля при комнатной температуре 24 л/моль или 2,4. 104 см3/моль; в одном моле SiCl4 содержится 28 [г/моль] кремния)
За время процесса через реактор проходит q0' = 16,7 q t п= 16,7 Q . C t п [см3] = = 7. 10-4 Q . C t п [моль] SiCl4 = 2,09 .10-2.Q . C t п [ г. ] кремния = P2. ( 2 )
Количество осаждённого на подставке кремния: P1 = V'. SП . t п . γ= 10-4.V. SП . t п.γ ( 3 ).
Здесь γ - плотность (для кремния γ= 2,32 г/см3 );
Таким образом, выход кремния
ζ = P1/ P2=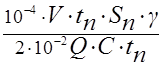 = 4,8.10-3
= 4,8.10-3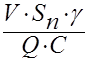 ( 4 ).
( 4 ).
Здесьзначения V , Q , можно брать в тех единицах, которые оговорены в задании и получены в эксперименте, SП- в см2 .
Оценка площади подставки.
Как уже отмечалось выше, реакция происходит практически на верхней торцевой и боковой поверхности цилиндрической подставки. Радиус подставки задан, высота определяется диаметром кремниевых подложек (задано) - по высоте подставки размещается 3 пластины с расстоянием между ними 1 см ; от нижней и верней пластин до краев подставки расстояния также по 1 см. Таким образом, высота цилиндра равна : h= 3d + 4 см, где d - диаметр пластин.
Продукты реакции и их утилизация.
В соответствии с реакцией ( 1 ) ПГС на выходе из реактора содержит непрореагировавший водород (более 90 %), непрореагировавший тетрахлорид кремния (SiCl4) и продукт реакции ( 1 ) - HCl. С точки зрения техники безопасности водород взрывоопасен, HCl токсичен, а SiCl4 при взаимодействии с водой и ее парами вступает в реакцию с образованием HCl :
SiCl4 + 2H2O = SiO2 + 4HCl ( 5 )
Как видно, 1 моль как прореагировавшего, так и непрореагировавшего SiCl4 в конечном итоге образует 4 моля HCl. Для утилизации прореагпировавшая ПГС поступает в специальное устройство ("скруббер"), где водород сгорает, а HCl растворяется в воде и образовавшаяся соляная кислота поступает в кислотный слив, где затем нейтрализуется раствором соды (или щёлочи) в соответствии с реакциями : Na2CO3+2HCl = 2NaCl+H2CO3 . ( 6 )
NaOH+HCl = NaCl+H2O ( 6а )
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.