







З А Н Я Т И Е N 3
ТЕМА: Оксидиметрия.
Теоретические основы перманганатометрии
1. ЗНАЧИМОСТЬ ИЗУЧАЕМОЙ ТЕМЫ: Окислительно-восстановительные процессы (ОВП) играют важную роль в обмене веществ и энергии, происходящем в организме человека и животных. На использовании ОВ реакций основаны многие методы, применяемые в количественном анализе и получившие общее название методов оксидиметрии.
В практике клинических, судебно-экспертных исследований, а также при испытании фармпрепаратов наиболее широкое распространение получили методы перманганатометрии, иодометрии, броматометрии и т.д.
Методами оксидиметрии в клинических и биохимических исследованиях определяют содержание ферментов каталазы, пероксидазы, диастазы, аскорбиновой кислоты, сахара в крови, мочевой кислоты в моче, ионов кальция в сыворотке крови и др. Оксидиметрию используют для контроля качества пероксида водорода, лактата и глюконата кальция, сульфаниламидов, анальгина, витаминов и других фармпрепаратов.
2. ЦЕЛЬ ЗАНЯТИЯ: Изучить теоретические основы окислительно-восстановительных процессов и методов оксидиметрического титрования на примере перманганатометрии.
3. ЗАДАЧИ: после изучения темы
а) студент должен знать:
- сущность ОВ реакций, типы ОВР;
- важнейшие окислители и восстановители;
- общую характеристику и классификацию методов оксидиметрии;
- использования методов оксидиметрии в клинических и биохимических исследованиях;
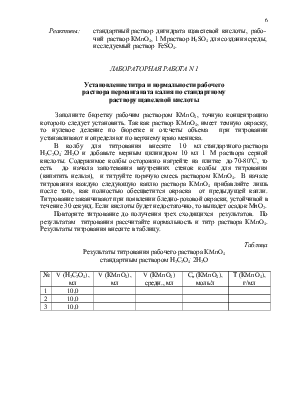
- окислительные свойства KMnO4 в разных средах, как объясняется различие в течении реакции окисления калия перманганатом в кислой среде от течения этой реакции в щелочной (или нейтральной) среде;
- теоретические основы метода перманганатометрии: рабочий раствор (особенности его приготовления), стандартный раствор, автокаталический характер реакции, установление титра раствора KМnO4 по щавелевой кислоте, фиксирование точки эквивалентности.
б) студент должен уметь:
- составлять уравнения ОВ реакций;
- расставлять коэффициенты в ОВР методом ионно-электронных схем;
- решать расчетные задачи по перманганатометрии;
- выполнять статистическую обработку данных.
в) приобрести практические навыки:
- по безиндикаторному перманганатометрическому титрованию;
- по выполнению количественных расчетов.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ:
1. Сущность ОВ реакций. Важнейшие окислители и восстановители. Типы ОВР. Методы электронного баланса и ионно-электронных схем.
2. Теоретические основы перманганатометрии. Влияние рН на окислительную способность веществ. Окислительные свойства KМnO4 в различных средах. Демонстрационный эксперимент: показать взаимодействие калия перманганата с натрия сульфитом в кислой, щелочной и нейтральной средах, записать соответствующие уравнения реакций и расставить коэффициенты методом полуреакций.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКСИДИМЕТРИИ:
Окислительно-восстановительными называются реакции, протекающие с изменением степеней окисления атомов. Для составления уравнений ОВ реакций используют два метода: 1) метод электронного баланса; 2) электронно-ионный метод (метод полуреакций).
Метод электронного баланса рекомендуется использовать для реакций, протекающих в газовой или твердой фазах.
Электронно-ионный метод применяется для составления уравнений ОВ реакций, протекающих в водных растворах. Этот метод основан на составлении двух полуреакций: для окисления восстановителя и восстановления окислителя, а затем суммирование их в общее ионное уравнение. При использовании этого метода степени окисления атомов элементов в составе реагирующих веществ не определяют, а в полуреакциях записывают ионы или молекулы сопряженных окисленной и восстановленной форм в том виде, как они существуют в растворе в условиях проведения реакций. Метод полуреакций учитывает реально существующие ионы в растворе, а слабые электролиты, газы, малорастворимые вещества записывают в молекулярном виде.
Метод полуреакций учитывает роль среды. Если реакция протекает в кислой среде, то в полуреакции могут быть включены только молекулы H2O и ионы водорода Н+. На каждый недостающий атом кислорода в одной из частей полуреакции нужно добавить по одной молекуле воды, тогда во вторую часть полуреакции пойдет удвоенное число ионов водорода.
Составим уравнение реакции окисления сульфита натрия перманганатом калия в кислой среде:
5 Na2SO4 + 2 KМnO4 + 3 H2SO4 = 5 Na2SO4 + 2 MnSO4 + K2SO4 + 3 H2O
![]()
SO32- + H2O - 2 е → SO42- + 2 H+ 5
MnO4- + 8 H+ + 5 е → Mn2+ + 4 H2O 2
5SO32- + 5H2O + 2MnO4- + 16H+ → 5SO42- + 10H+ + 2Mn2+ + 8H2O
После приведения подобных членов получим ионное уравнение реакции
в сокращенной форме:
5 SO32- + 2 MnO4- + 6 H+ → 5 SO42- + 2 Mn2+ + 3 H2O
По ионному уравнению расставляют коэффициенты в молекулярном.
Если реакция протекает в щелочной среде, то в полуреакции могут быть включены только молекулы воды и ионы ОН-. На каждый недостающий в одной из частей полуреакции атом кислорода нужно добавить по два иона ОН-, тогда во второй части реакции пойдет уменьшенное в два раза число молекул воды.
Na2SO4 + 2 KМnO4 + 2 KOH = Na2SO4 + 2 K2MnO4 + H2O
SO32- + 2 OH- - 2 е → SO42- + H2O 1
MnO4- + 1 е → MnO42- 2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.