








З А Н Я Т И Е N 7
ТЕМА: Кислотно-основное равновесие.
Водородный показатель рН.
Буферные растворы. Буферные системы крови
1. ЗНАЧИМОСТЬ ТЕМЫ: Поддержание кислотно-основного и электролитного равновесия в тканях, биологических жидкостях крайне важно для нормального функционирования организма. Изменение электролитного состава приводит к изменению реакции среды биологических жидкостей. Во-первых, ионы Н+ оказывают каталитическое действие на многие биохимические превращения. Во-вторых, ферменты и гормоны проявляют биологическую активность только в строго определенном интервале значений рН (например, фермент пепсин, участвующий в расщеплении пищи в желудке, активен только при рН = 1,5). В-третьих, даже небольшие изменения концентрации ионов Н+ ощутимо влияют на величину осмотического давления в этих жидкостях. Поддержание постоянного рН в крови и тканевых жидкостях регулируется с помощью нескольких буферных систем. Одним из способов диагностики заболеваний является определение рН желудочного сока, крови, мочи.
2. ЦЕЛЬ: Ознакомить студентов-медиков с основными положениями теории электролитической диссоциации, с теориями сильных и слабых электролитов, а также с ролью электролитов в организме человека. Сформировать представления о кислотно-основном равновесии в организме человека и биологических буферных системах, поддерживающих кислотно-основной гомеостаз.
3. ЗАДАЧИ: после изучения темы
а) студент должен знать:
- основные положения теории электролитической диссоциации;
- понятие о сильных и слабых электролитах;
- понятие о буферных растворах;
- механизм действия буферных растворов;
- буферные системы организма.
б) студент должен уметь:
- решать расчетные задачи по вычислению степени диссоциации, концентрации ионов водорода и рН растворов сильных электролитов;
- решать расчетные задачи по вычислению степени диссоциации, концентрации ионов водорода и рН растворов слабых электролитов;
- решать расчетные задачи на вычисление рН буферных растворов.
в) приобрести практические навыки:
- по определению рН сильных и слабых электролитов различными методами;
- по выполнению расчетных задач.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ:
1. Кислотно-основное равновесие в растворах.
2. Диссоциация воды. Ионное произведение воды. Водородный показатель и методы его определения.
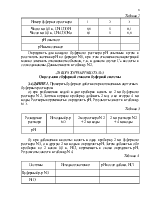
3. Буферные системы: определение, классификация и механизм действия. Расчет буферных систем.
4. Определение буферной емкости системы. От каких факторов она зависит?
5. Буферные системы крови. Механизм кислотно-щелочного равновесия в организме человека.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КИСЛОТНО-ОСНОВНОГО РАВНОВЕСИЯ
Согласно ионной теории КИСЛОТЫ - соединения, которые при электролитической диссоциации в водном растворе образуют ионы водорода Н+:
НАи ↔ Н+ + Аи-
ОСНОВАНИЯ - соединения, которые при электролитической диссоциации в водном растворе образуют ионы гидроксила ОН-:
KtОН ↔ Kt+ + ОН-
Рассматривая кислотно-основные равновесия в водных растворах в дальнейшем будем считать их приближающимися к идеальным растворам, т.е. активностью ионов пренебрегаем (а → с).
Тогда в соответствии с законом действующих масс:
[Н+] . [Аи-]
![]() К (НАи) = (1)
К (НАи) = (1)
[НАи]
[Kt+] . [ОН-]
![]() К (KtОН) = (2)
К (KtОН) = (2)
[KtОН]
Вода проявляет как слабые кислотные, так и основные свойства (амфолит): Н2О ↔ Н+ + ОН-,
[H+] . [ОН-]
![]() тогда К (Н2О)
= (3)
тогда К (Н2О)
= (3)
[Н2О]
При 25оС К(Н2О) = 1,8.10-10 (может быть вычислен по электропроводности воды). Можно считать, что С (Н2О) - величина постоянная и равна 55,58 моль/л. Следовательно:
К(Н2О) . [Н2О] = 1,8.10-1 . 55,58 = 10-14
Обозначим К (Н2О).[Н2О] = КW, где КW - ионное произведение воды - величина постоянная при данной температуре не только для чистой воды, но и для разбавленных водных растворов любых веществ. С повышение температуры увеличивается, с понижением - уменьшается.
КW = [Н+] . [ОН-] = 10-14 (при 25оС) (4)
КW дает возможность рассчитать концентрацию Н+ при известной концентрации ОН- и наоборот.
![]() Для чистой
воды (среда нейтральная):
Для чистой
воды (среда нейтральная):
[Н+] = [ОН-] = ![]() KW = 10-7 моль/л
KW = 10-7 моль/л
Если [Н+] выше 10-7 моль/л, а [ОН-], соответственно, ниже, то среда кислая и наоборот.
При расчетах [Н+] удобнее выражать через ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ рН - отрицательный десятичный логарифм молярной концентрации ионов водорода в растворе: рН = -lg Н+,
соответственно, рОН = - lg[ОН-] и рН + рОН = 14 (5)
Величиной рН пользуются для характеристики разбавленных водных растворов. рН < 7 - среда кислая; рН = 7 - нейтральная; рН > 7 - щелочная.
Для приблизительного определения рН среды служат кислотно-основные ИНДИКАТОРЫ - слабые органические кислоты или основания, ионные и молекулярные формы которых имеют различную окраску, указывающую на рН среды. Например, в растворе индикатора метилового оранжевого устанавливается равновесие:
НInd ↔ Н+ + Ind+,
красный желтый
смещающееся в зависимости от рН среды.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.