Федеральное агентство по образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
”Сибирский Государственный технологический университет”
Кафедра аналитической химии и технологии электрохимических производств
Факультет Химических Технологий
РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА
РАСЧЁТ КРИВЫХ ТИТРОВАНИЯ
Руководитель:
______________________________
(подпись)
______________________________
(дата, оценка)
Разработал:
Студент группы 62-3
________________Калинин Н. С.
(подпись)
_________________________
(дата)
Задание
Рассмотрим титрование сильной кислоты сильным основанием на примере титрования соляной кислоты раствором гидроксида натрия.
HCl+NaOH → NaCl+H2O - в молекулярной форме,
H+ + OH- → H2O - в ионной форме.
Пусть титруется 100см3 раствора соляной кислоты с молярной концентрацией эквивалента 0,25 моль/дм3 раствором основания NaOH с молярной концентрацией эквивалента 0,2 моль/дм3. При расчете кривой титрования необходимо рассмотреть и определить значение pH в начальный момент, в процессе титрования, в точке эквивалентности, и за точкой эквивалентности.
1. В начальный момент у нас имеется раствор сильной кислоты. Не учитывая изменения ионной силы раствора, определим водородный показатель раствора pH по формуле:
![]() ,
,
где [H+]- молярная концентрация эквивалента кислоты, моль/дм3.
С[1/1HCl]=0.25 моль/дм3.
![]() =-lg0.25=0.6.
=-lg0.25=0.6.
2 В процессе титрования, при добавлении к кислоте раствора гидроксида натрия часть кислоты расходуется на образование поваренной соли- хлорида натрия NaCl, поэтому концентрация ионов водорода до точки эквивалентности начинает уменьшаться. Молярную концентрацию эквивалента кислоты в процессе титрования рассчитываем по формуле:
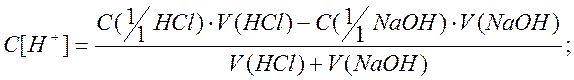
где![]() -
молярная концентрация эквивалента щелочи, моль/дм3,
-
молярная концентрация эквивалента щелочи, моль/дм3,
добавленной в процессе титрования. Обозначим её через Сщ;
V(HCl)- объем кислоты, взятой для анализа, см3, V(HCl)= Vк;
V(NaOH)- объем щелочи, добавленной в процессе титрования, см3, V(NaOH)=Vщ.
Тогда формула (1.2) примет вид:
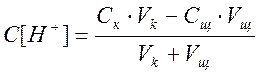
а) Пусть добавлено 50 см3 NaOH, тогда
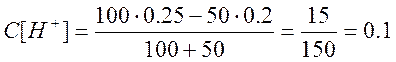 ,
, ![]()
Аналогично рассчитываем pH в точках, когда добавлено 90; 99; 99,9 см3 раствора NaOH.
б) Добавлено 90 см3 NaOH,
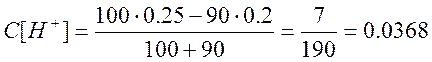
![]()
в)добавлено 124 см
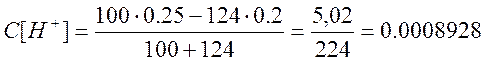
![]()
г)добавлено 124,9 см
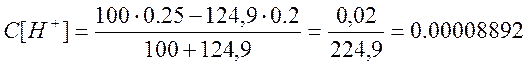
![]()
3. В точке эквивалентности добавлено 125 см3 раствора NaOH, т.е. в раствор вводят как раз эквивалентное имевшейся кислоте количество щелочи, т.е. достигают точки эквивалентности. В этот момент раствор будет содержать только образовавшуюся при реакции соль NaCl. Но так как последняя не подвергается гидролизу, pH раствора можно определить, исходя из ионного произведения воды.
![]()
![]()
![]()
4. За точкой эквивалентности наблюдается избыток щелочи. В этом случае расчет pH, без учета разбавления, проводится по формуле расчета pH сильного основания
![]()
где 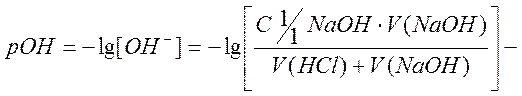 гидроксильный
показатель раствора.
гидроксильный
показатель раствора.
а) Пусть добавлено125,1 см3 раствора NaOH,
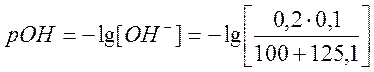
![]()
![]()
б) Добавлено 126 см3 раствора NaOH,
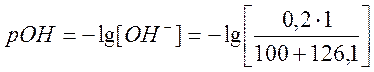
![]()
![]()
в) Добавлено 135 см3 раствора NaOH,
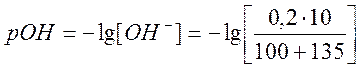
![]()
![]()
г) Добавлено 150 см3 раствора NaOH,
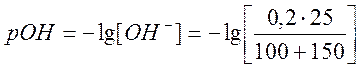
![]()
![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.