
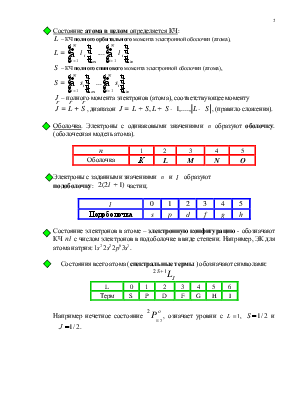


![]() Состояние электрона в атоме в
одноэлектронном приближении определяется 4-мя квантовыми числам и
четностью:
Состояние электрона в атоме в
одноэлектронном приближении определяется 4-мя квантовыми числам и
четностью:
|
представление ВФ в виде |
|
|
n – главное КЧ |
n = 1, 2,3….∞; |
|
|
|
|
|
|
|
|
|
|
представление ВФ в виде |
|
|
n – главное КЧ |
n = 1, 2,3….∞; |
|
|
|
|
|
|
|
|
|
|
четность
|
нечетное состояние обозначается о |
Переход
![]() →
→ 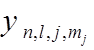 можно
осуществить с помощью коэффициентов Клебша- Гордона
можно
осуществить с помощью коэффициентов Клебша- Гордона
![]() –
КЧ полного орбитального момента электронной оболочки (атома),
–
КЧ полного орбитального момента электронной оболочки (атома), 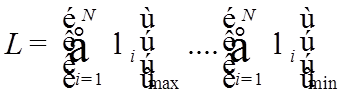
![]() – КЧ полного
спинового момента электронной оболочки (атома),
– КЧ полного
спинового момента электронной оболочки (атома), 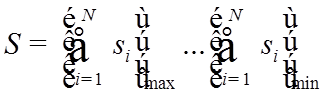
![]() –
полного момента электронов (атома), соответствующее моменту
–
полного момента электронов (атома), соответствующее моменту ![]() , диапазон
, диапазон ![]() ,
(правило сложения).
,
(правило сложения).
![]() Оболочка.
Электроны с одинаковыми значениями
Оболочка.
Электроны с одинаковыми значениями ![]() образуют оболочку.
(оболочесная модель атома).
образуют оболочку.
(оболочесная модель атома).
|
|
1 |
2 |
3 |
4 |
5 |
Оболочка |
К |
L |
M |
N |
O |
![]() Электроны с заданными значениями
Электроны с заданными значениями ![]() и
и ![]() образуют
образуют
подоболочку: ![]() частиц.
частиц.
|
|
0 |
1 |
2 |
3 |
4 |
5 |
|
Подоболочка |
s |
p |
d |
f |
g |
h |
![]() Состояние электронов в атоме – электронную
конфигурацию - обозначают КЧ
Состояние электронов в атоме – электронную
конфигурацию - обозначают КЧ ![]() с числом электронов в
подоболочке в виде степени. Например, ЭК для атома натрия:
с числом электронов в
подоболочке в виде степени. Например, ЭК для атома натрия: ![]()
![]() .
.
![]()
Состояния всего атома (спектральные термы )
обозначают символами: 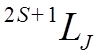
L |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
Терм |
S |
P |
D |
F |
G |
H |
I |
Например
нечетное состояние 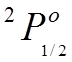 , означает уровни с
, означает уровни с ![]()
![]() и
и ![]()
![]() .
.
![]() Водород и
сходные с ним ионы
Водород и
сходные с ним ионы ![]()
![]() , ….:
, ….:
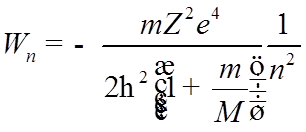
Нет зависимости от ![]() (!); случайное (кулоновское)
вырождение.
(!); случайное (кулоновское)
вырождение.
![]() Атомы щелочных
металлов :
Атомы щелочных
металлов :
![]()
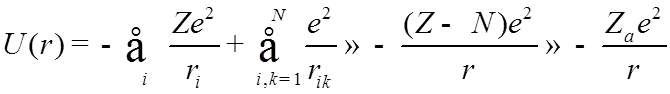
где ![]() -
эффективный заряд остова.
-
эффективный заряд остова.
![]() Разлагая
поле остова по мультипольным моментам и учитывая только дипольную составляющую,
получим:
Разлагая
поле остова по мультипольным моментам и учитывая только дипольную составляющую,
получим:
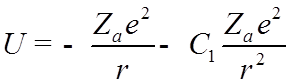 ,
,
![]() - постоянная.
- постоянная.
![]() Радиальная часть УШ
Радиальная часть УШ
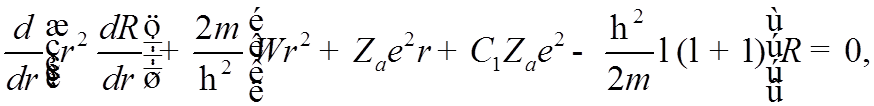
совпадет с уравнением для Н, если обозначить последние два члена в квадратных скобках следующим образом:
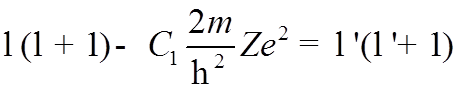 . (*)
. (*)
![]() Решая (*), находим
Решая (*), находим
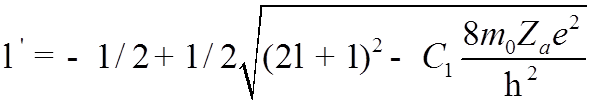 .
.
Предполагая
![]() малой, окончательно получим
малой, окончательно получим
![]()
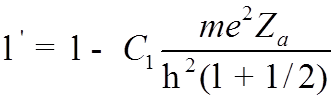 .
.
![]() Приведя, таким образом, УШ к водородоподобному виду,
которое при
Приведя, таким образом, УШ к водородоподобному виду,
которое при ![]() имеет решения лишь при
имеет решения лишь при
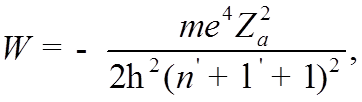
Обозначив скобку и подставив ![]() , получим
, получим
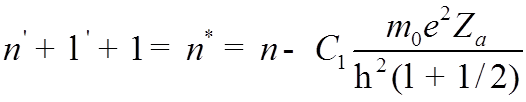 =
= ![]() ,
,
![]() – эффективное КЧ, а
– эффективное КЧ, а ![]() – квантовый дефект или поправка
Ридберга
– квантовый дефект или поправка
Ридберга
![]() Таким образом, учет взаимодействия электронов,
приводит к снятию вырождения по
Таким образом, учет взаимодействия электронов,
приводит к снятию вырождения по ![]()
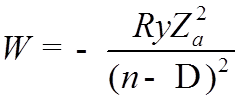
![]()
Пример: зависимость энергии атома Na от n и ![]() для электрона в верхней оболочке.
для электрона в верхней оболочке.
Энергия связи электрона в атоме H:
|
состояние |
n=2 |
n=3 |
|
энергия связи |
-3.6 эВ |
-1.54 эВ |
Энергия связи электрона в атоме Na:
|
состояние |
3s |
3p |
3d |
|
энергия связи |
-5.13 эВ |
-2.0 эВ |
-1.6 эВ |
![]() Квантовый
дефект
Квантовый
дефект ![]() для S- терма :
для S- терма :
|
Элемент |
n |
|
|
Li |
2 |
0,41 |
|
Na |
3 |
1,37 |
|
K |
4 |
2,23 |
|
Rb |
5 |
3,20 |
|
Gs |
6 |
4,13 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.