




НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ ЕСТЕСТВЕННЫХ НАУК
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
Лабораторная работа К-14
ИЗУЧЕНИЕ КИНЕТИЧЕСКОГО ИЗОТОПНОГО
ЭФФЕКТА В РЕАКЦИИ АЗОСОЧЕТАНИЯ.
Студенты:
Быков Максим Михайлович
Шабалин Антон Юрьевич
Преподаватель:
д.х.н. Талзи Евгений Павлович
НОВОСИБИРСК 2008 г.
Цель лабораторной работы – рассчитать kэфф, определить (kHэфф/kDэфф) – кинетический изотопный эффект.
Краткая теория : Кинетическим изотопным эффектом (КИЭФ) называют изменение скорости реакции при изменении изотопного состава. КИЭФ определяется как отношение константы скорости реакции частицы, содержащей легкий изотоп, к константе скорости частицы содержащей тяжелый изотоп (kH/kD). Изотопный эффект особенно велик в случае изотопов водорода, для которых различие в массах наибольшее. Ковалентная связь с дейтерием прочнее связи с протием, и реакция, в которой разрыв этих связей определяет скорость взаимодействия, должна быть более медленной в случае дейтерированного соединения. Поэтому наличие изотопного эффекта может быть использовано в качестве критерия разрыва связи с водородом в одной из стадий химической реакции.
Пусть KH и KD – константы скорости реакции частиц содержащих легкий и тяжелый изотоп. Метод активированного комплекса дает следующие выражения для констант скоростей:
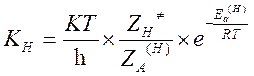 ,
,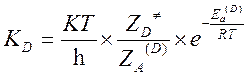
Откуда
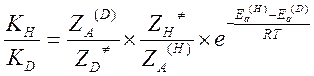
Поступательные и
вращательные статистические суммы для частиц, содержащих H
и D, в подавляющем большинстве случаев можно считать
практически одинаковыми. В первом приближении можно считать, что все
колебательные степени свободы частицы А сохраняются в активированном комплексе,
за исключением одной, которая переходит в поступательное движение вдоль
координаты реакции. Пусть частота, отвечающая этому колебанию, есть ν, а
частота остальных колебаний ν1, ν2, … ,νi . Если считать, что частоты
колебаний при превращении исходной частицы в активированный комплекс изменяются незначительно(![]() ), то
), то
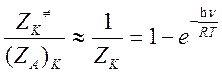
Следовательно, отношение колебательных статистических сумм равно
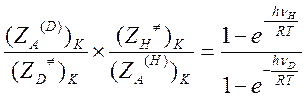
Если hν/RT>>1, то и числитель, и знаменатель этого выражения близки к единице. В этом случае величина изотопного эффекта равна
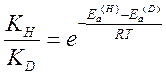
Если в ходе реакции разрывается связь R-H, т.е. реакция идет по схеме
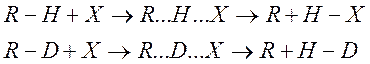
То νH и νD – соответственно частоты колебаний по связям R-H и R-D. Известно, что частота колебаний обратно пропорциональна квадратному из корню массы колеблющихся частиц.
Поэтому для реакций, идущих по выше приведенному типу
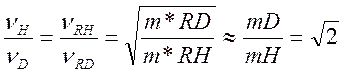
Где m* - приведенные массы.
Энергия активации может быть представлена как разность нулевых энергий активированного комплекса и исходных частиц. Ea= Eo#- Eo; выражая Eo# и Eo через частоты колебаний, получим
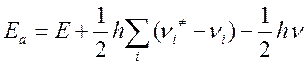
Где νi – все колебания, кроме колебания
по разрываемой связи (ν), E- высота потенциального
барьера реакции. Высота потенциального барьера без учета вклада нулевых энергий
не зависит от изотопного состава реагирующих частиц. Поэтому, считая ![]() , можно записать
, можно записать
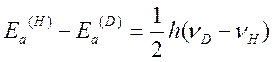
Для реакций, сопровождающихся разрывом связи R-H
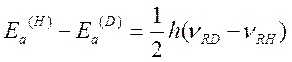
Рассмотрим реакцию азосочетания 2-нафтол-6,8-дисульфокислоты дикалиевой соли с диазосолью, полученной из п-Br-анилина. Реакция идет в буферном растворе с постоянным значением pH=7:
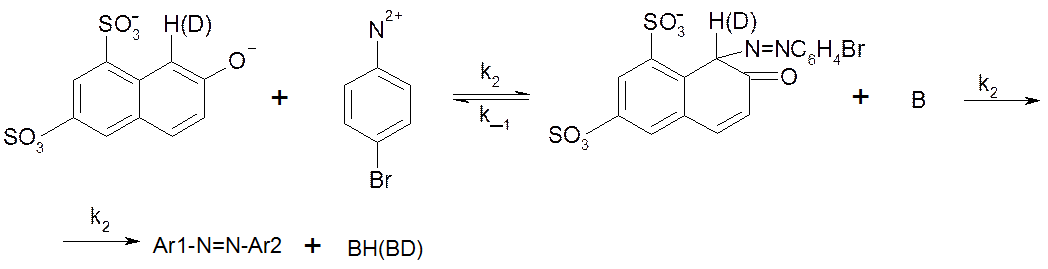
Здесь B – основание (вода, пиридин, пиколины).
В случае замены H на D в Ar1H реакция замедляется, KH/KD≈7. Это свидетельствует о том, что медленной стадией, лимитирующей скорость процесса в целом, является разрыв связи C-H или C-D в σ-комплексе. Для изучения механизма реакции можно воспользоваться методом квази-стационарных концентраций, считая σ-комплекс лабильной частицей:
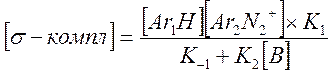
Разделим на K-1 числитель и знаменатель и подставим в выражение для скорости
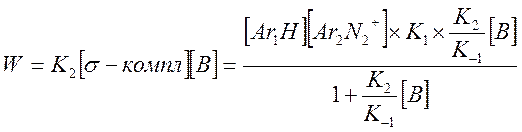
В случае если система содержит несколько оснований (вода + пиколин), предыдущее выражение запишется в виде
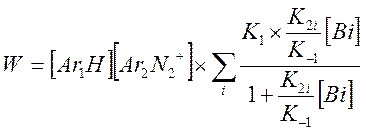
И выражение для Kэфф
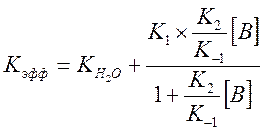
Где ![]() - измеренная константа скорости без
пиколина при тех же условиях реакции. При малых концентрациях В величиной
- измеренная константа скорости без
пиколина при тех же условиях реакции. При малых концентрациях В величиной ![]() в знаменателе можно пренебречь, т.к.
в знаменателе можно пренебречь, т.к. ![]() для пиколина равно 2.5, тогда
для пиколина равно 2.5, тогда
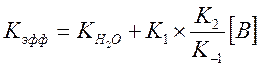
Проведение измерений и обработка результатов
Зная ![]() и
и 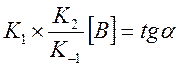 , в
координатах Kэфф от
, в
координатах Kэфф от![]() ,
нашли K1.
,
нашли K1.
Кинетику реакции
изучали по скорости образования продукта ![]() ,
имеющего желтую окраску. Обозначим
,
имеющего желтую окраску. Обозначим ![]() ; количество
образовавшегося продукта или глубина реакции = x.
; количество
образовавшегося продукта или глубина реакции = x.
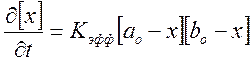
![]() , отсюда
, отсюда ,
,
![]() ,
,
![]() ,
,  ,
,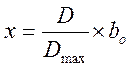
Разделим переменные и проинтегрируем, подставив значения х:
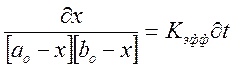
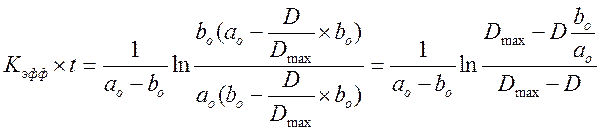
![]() нашли
из опыта с максимальным количеством раствора B.
нашли
из опыта с максимальным количеством раствора B. ![]() = 10.112
= 10.112
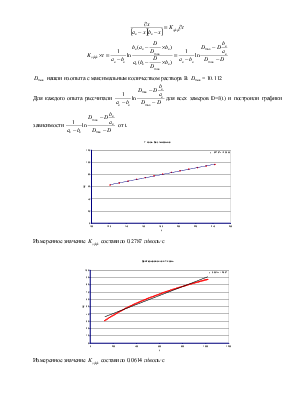
Для каждого
опыта рассчитали 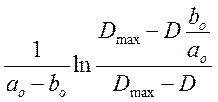 для всех замеров D=f(t) и построили
графики зависимости
для всех замеров D=f(t) и построили
графики зависимости 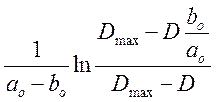 от t.
от t.
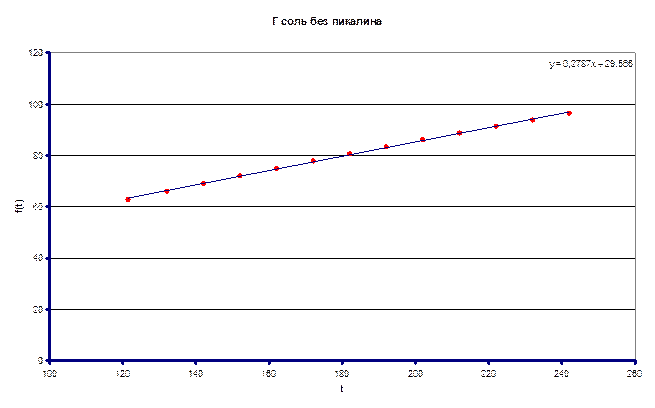
Измеренное значение ![]() составило 0.2787 л/моль·с
составило 0.2787 л/моль·с

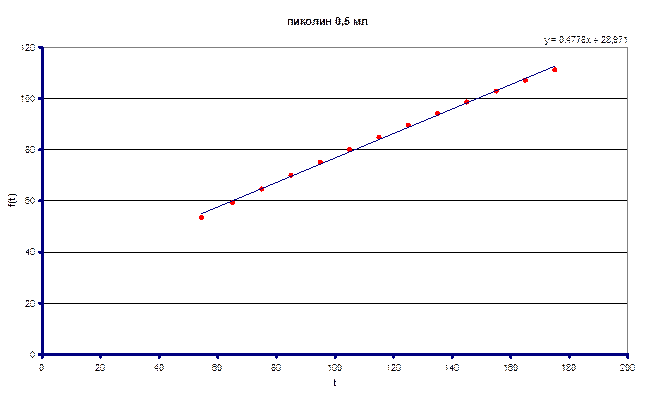
Измеренное значение ![]() составило 0.0614 л/моль·с
составило 0.0614 л/моль·с
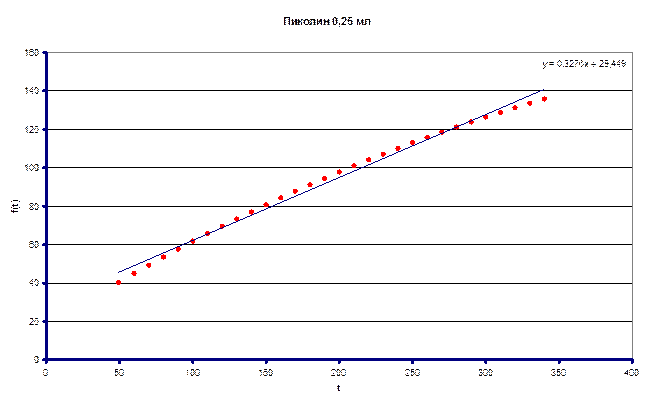
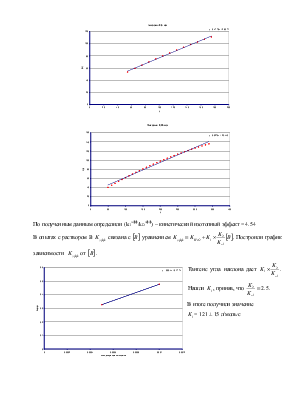
По полученным данным определили (kHэфф/kDэфф) – кинетический изотопный эффект = 4.54
В опытах с
раствором B ![]() связана с
связана с ![]() уравнением
уравнением
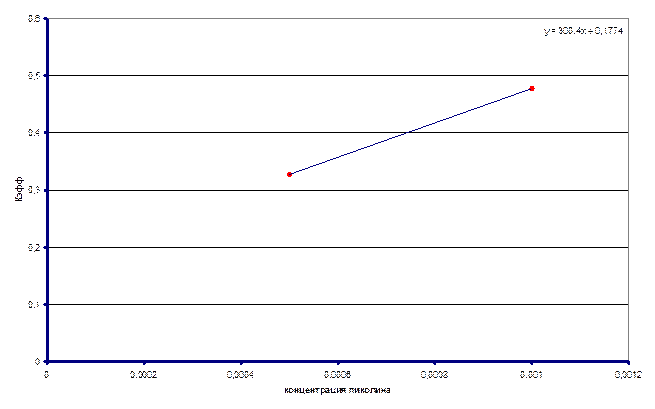
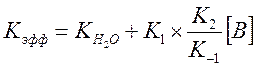 . Построили график зависимости
. Построили график зависимости ![]() от
от ![]() .
.
 Тангенс угла
наклона дает
Тангенс угла
наклона дает 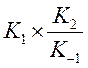 . Нашли
. Нашли ![]() ,
приняв, что
,
приняв, что 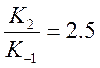 .
.
В итоге получили значение
![]() = 121 ± 15 л/моль∙с
= 121 ± 15 л/моль∙с
Выводы:
Результатом
данной работы явилось экспериментальное подтверждение существования
кинетического изотопного эффекта в реакции азосочетания, и определение его
значения. Полученное значение не совпадает со значением приведенным группой
учёных, впервые занимавшихся изучением КИЭ для данной реакции в 1955 году, но
более современная научная литература указывает на диапазон изменения КИЭ в
пределах от 3,5 до 6, в зависимости от условий проведения эксперимента, что
вполне согласуется с полученными нами результатами. Существенным недостатком
работы является наличие всего двух точек экспериментальной зависимости
эффективной константы скорости от концентрации пиридина в растворе, что позволяет
не доверять полученному значению ![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.