В п. 1 показано, что для реакции между атомами ![]() можно найти из соотношения
можно найти из соотношения
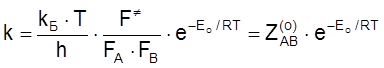 , (4.47)
, (4.47)
т. е.
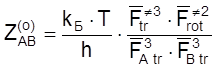 . (4.48)
. (4.48)
Полагая (при грубых оценочных расчетах) величины Fi для одинаковых степеней свободы разных частиц по порядку величины одинаковыми, получаем из соотношения (4.48), что
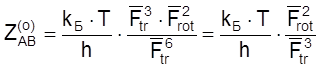 .
(4.49)
.
(4.49)
При обычных (не слишком высоких) температурах типичными для статсумм являются значения
![]() см–1,
см–1, ![]() ,
, ![]() .
.
Подставляя в формулу (4.46) выражение (4.49) для ![]() и выражения типа (4.43) или (4.44) для
статсумм активированного комплекса и исходных молекул, можно оценить значения
стерического фактора f для бимолекулярных реакций между
молекулами разного типа.
и выражения типа (4.43) или (4.44) для
статсумм активированного комплекса и исходных молекул, можно оценить значения
стерического фактора f для бимолекулярных реакций между
молекулами разного типа.
Случай 1. Реакция между атомом A и n-атомной линейной молекулой B, идущая через линейный активированный комплекс:
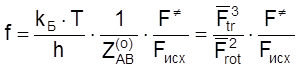 . (4.50)
. (4.50)
Для ![]() и
и ![]() имеем
имеем
![]() ,
,
![]() .
.
Отсюда
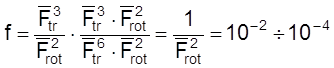 .
.
Случай 2. Реакция между атомом A и n-атомной линейной молекулой, идущая через нелинейный активированный комплекс.
Для ![]() и
и ![]() имеем
имеем
![]() ,
,
![]() ,
,
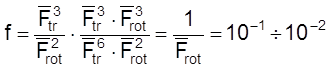 .
.
Случай 3. Реакция между атомом и нелинейной n-атомной молекулой. Активированный комплекс в этом случае нелинейный.
Для ![]() и
и ![]() имеем
имеем
![]() ;
; ![]() .
.
Тогда
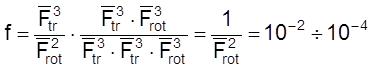 .
.
Случай 4. Реакция между двумя линейными молекулами, идущая через линейный активированный комплекс.
Для ![]() и
и ![]() имеем
имеем
![]() ;
; ![]() .
.
Тогда
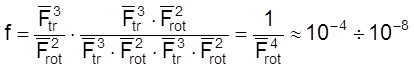 .
.
Случай 5. Реакция между двумя линейными молекулами, идущая через нелинейный активированный комплекс. В этом случае
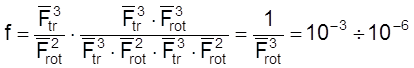 .
.
Случай 6. Реакция между линейной и нелинейной молекулами. В этом случае активированный комплекс нелинейный и
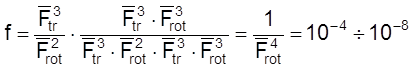 .
.
Случай 7. Реакция между двумя нелинейными молекулами. В этом случае активированный комплекс нелинейный и
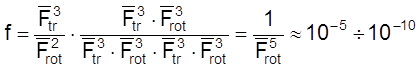 .
.
Как видим, значения стерического фактора могут изменяться от
![]() для реакции между атомами до
для реакции между атомами до ![]() для реакций между нелинейными многоатомными
молекулами. Интервал
для реакций между нелинейными многоатомными
молекулами. Интервал ![]() перекрывает практически весь
диапазон значений f, который до сих пор удавалось
наблюдать экспериментально. В этом согласии с экспериментом – большой успех теории
активированного комплекса.
перекрывает практически весь
диапазон значений f, который до сих пор удавалось
наблюдать экспериментально. В этом согласии с экспериментом – большой успех теории
активированного комплекса.
До сих пор наши расчеты f носили
грубо оценочный характер. Однако, рассматривая конкретные реакции и задаваясь
для них конкретной структурой активированного комплекса, можно оценивать
значения f со значительно большей точностью. Все же,
учитывая приближенный характер теории активированного комплекса и отсутствие
достаточно надежных данных о структуре активированного комплекса, вряд ли стоит
требовать от этой теории большего, чем предсказание порядка величины
предэкспоненциального множителя ![]() и стерического фактора
f.
и стерического фактора
f.
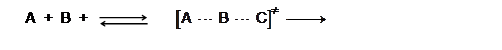 Теория активированного комплекса
позволяет легко вычислить число тройных столкновений. Для безактивационной
реакции (т. е. реакции с
Теория активированного комплекса
позволяет легко вычислить число тройных столкновений. Для безактивационной
реакции (т. е. реакции с ![]() ) между тремя атомами
) между тремя атомами
А + B + C ![]() [A … В … C]¹
[A … В … C]¹ ![]() P,
P,
имеем
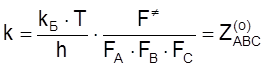 , (4.51)
, (4.51)
где ![]() –
фактор тройных столкновений, т. е. число тройных столкновений в единице
объема в единицу времени при единичных концентрациях частиц A,
B и C.
–
фактор тройных столкновений, т. е. число тройных столкновений в единице
объема в единицу времени при единичных концентрациях частиц A,
B и C.
Общее число тройных столкновений в единице объема в единицу времени
![]() .
.
Используя приближенные величины ![]() ,
, ![]() и
и ![]() , для фактора
тройных соударений имеем
, для фактора
тройных соударений имеем
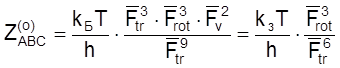 .
(4.52)
.
(4.52)
Учтем, что при ![]()
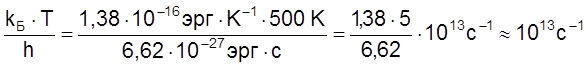 ,
,
а
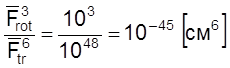 .
.
(Мы рассматриваем для определенности
столкновения малых молекул, поэтому принимаем значение ![]() ,
т. е. равное нижней границе типичного интервала для
,
т. е. равное нижней границе типичного интервала для ![]() .) Тогда получаем, что
.) Тогда получаем, что
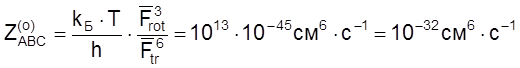 .
.
Это значение ![]() в пределах точности
оценок совпадает с нормальным значением предэкспоненциального множителя
для тримолекулярных реакций
в пределах точности
оценок совпадает с нормальным значением предэкспоненциального множителя
для тримолекулярных реакций ![]() cм6 × c–1, оцененного нами в п. 3 разд. 2.1.4
из простейших соображений.
cм6 × c–1, оцененного нами в п. 3 разд. 2.1.4
из простейших соображений.
Стерический фактор для тримолекулярных реакций между частицами различного строения можно оценить тем же способом, что и для бимолекулярных реакций:
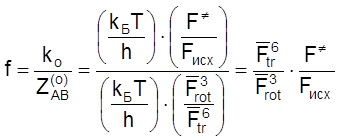 . (4.53)
. (4.53)
Например, для реакции между тремя нелинейными молекулами:
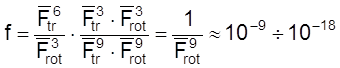 .
.
Для реакции между двумя атомами и многоатомной нелинейной молекулой:
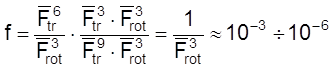 .
.
Для реакции между двумя атомами и двухатомной молекулой, протекающей через линейный активированный комплекс:
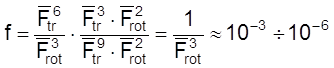 .
.
Вероятность тройных столкновений мала, поэтому в газовой фазе тримолекулярные реакции обычно играют существенную роль только в тех случаях, когда их энергия активации равна нулю или мала. Примером важной тримолекулярной реакции является рекомбинация атомов A и B:
![]()
в присутствии третьей частицы M. Роль M состоит в отводе энергии от AB, благодаря чему молекула AB не диссоциирует назад на атомы A и B.
В жидкой фазе, где концентрации реагентов могут быть более высокими, чем в газах, тримолекулярные реакции более вероятны.
Мономолекулярные реакции очень распространены, особенно при высоких температурах. К ним относятся реакции распада и изомеризации молекул, свободных радикалов и ионов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.