Статистическая сумма по электронным состояниям:
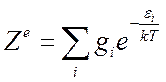 (7.18),
(7.18),
![]() – энергия
– энергия ![]() уровня,
уровня,
![]() – статистический вес этого
уровня.
– статистический вес этого
уровня.
Найдем определяющую систему для расчета состава газа в равновесной химической реакции, для чего воспользуемся условием равновесия
![]()
![]() (7.19).
(7.19).
Используя выражение свободной энергии (7.13), из (7.19) находим:
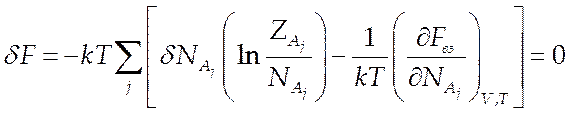 (7.20).
(7.20).
Заменяя ![]() пропорциональными
им величинами стехиометрических коэффициентов
пропорциональными
им величинами стехиометрических коэффициентов ![]() ,
получим
,
получим
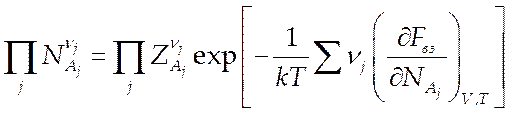 (7.21).
(7.21).
Уравнение (7.21) есть универсальное уравнение равновесия для системы, в которой идут произвольные реакции, с учетом слабого взаимодействия.
Учет
взаимодействия при нормальных плотностях необходим лишь для дальнодействующих
потенциалов – при рассмотрении ионизационного равновесия. Для реакции в среде
нейтральных частиц взаимодействие становится заметным при давлениях ![]() .
.
Диссоциация двухатомных молекул.
При температурах порядка нескольких тысяч градусов Кельвина двухатомные молекулы обычно диссоциируют на атомы. Многоатомные молекулы, в которых связь слабее, начинают распадаться при более низких температурах. Рассмотрим реакцию диссоциации двухатомных молекул типа
![]() или
или ![]() (7.22).
(7.22).
Запишем условие сохранения числа частиц
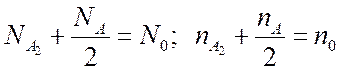 (7.23),
(7.23),
где ![]() начальное число молекул (
начальное число молекул (![]() начальное число молекул в единице объема).
Определим степень диссоциации как
начальное число молекул в единице объема).
Определим степень диссоциации как
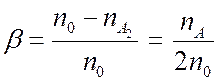 ; (7.24).
; (7.24).
Из (7.23) и
(7.24) имеем, ![]() . Запишем уравнение состояния
диссоциирующего газа
. Запишем уравнение состояния
диссоциирующего газа
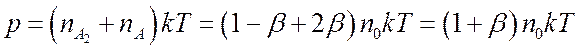 (7.25)
(7.25)
или
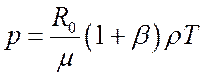 (7.26).
(7.26).
Удельная (на единицу объема) внутренняя энергия газа будет:
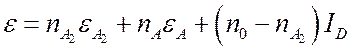 (7.27).
(7.27).
Здесь ![]() - есть средние значения энергии
поступательного, вращательного и колебательного видов движения соответственно,
а
- есть средние значения энергии
поступательного, вращательного и колебательного видов движения соответственно,
а ![]() - среднее значение энергии по
электронным состояниям частицы.
- среднее значение энергии по
электронным состояниям частицы. 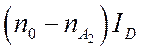 - энергия,
затрачиваемая на диссоциацию,
- энергия,
затрачиваемая на диссоциацию, ![]() - потенциал диссоциации.
Например, для молекул кислорода
- потенциал диссоциации.
Например, для молекул кислорода ![]() , азота
, азота ![]() , окиси азота
, окиси азота ![]() .
.
С учетом (7.23) и (7.24) выражение (7.27) запишется
![]() (7.28).
(7.28).
Обычно
диссоциация начинается при температурах гораздо меньших чем ![]() . Это связано с тем, что при
. Это связано с тем, что при ![]() молекулы разбиваются ударами очень
энергичных частиц из «Максвелловского хвоста» распределения.
молекулы разбиваются ударами очень
энергичных частиц из «Максвелловского хвоста» распределения.
Для реакции
(7.22) ![]() и при
и при ![]() из
(7.21) находим
из
(7.21) находим
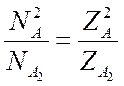 (7.29).
(7.29).
Поскольку статистические суммы
пропорциональны объему ![]() , который входит только в
, который входит только в ![]() , а, в остальном, зависят только от температуры,
то переходя к концентрациям
, а, в остальном, зависят только от температуры,
то переходя к концентрациям ![]() вместо (7.29) можно
записать
вместо (7.29) можно
записать
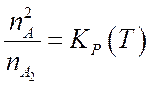 (7.30).
(7.30).
![]()
![]() есть константа равновесия для реакции
диссоциации. Подставим в (7.29) значения статистических сумм из (7.15) –
(7.18). В
есть константа равновесия для реакции
диссоциации. Подставим в (7.29) значения статистических сумм из (7.15) –
(7.18). В ![]() положим
положим 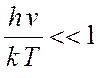 (колебания
в молекулах возбуждены полностью), тогда
(колебания
в молекулах возбуждены полностью), тогда 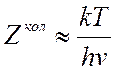 , а в
электронных суммах ограничимся первыми членами:
, а в
электронных суммах ограничимся первыми членами:
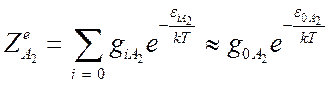 ,
, 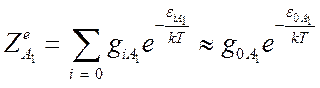 и
и 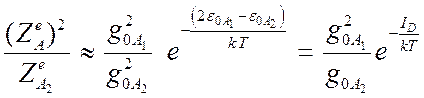 , так как разность энергии низких уровней
, так как разность энергии низких уровней ![]() по определению есть энергия диссоциации
по определению есть энергия диссоциации ![]() .
.
В итоге для
константы равновесия с учетом, что 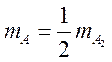 получим
получим
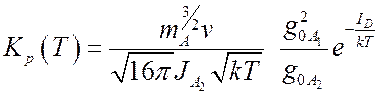 (7.31).
(7.31).
Переходя в (7.30) от ![]() к степени диссоциации
к степени диссоциации ![]() и плотности
и плотности ![]() получим
получим
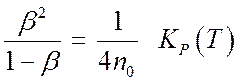 (7.32).
(7.32).
Используя уравнение состояния (7.26), из (7.32) можно получить
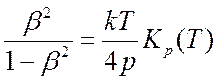 (7.33).
(7.33).
При малых степенях диссоциации 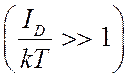 будем иметь
будем иметь ![]() и
степень диссоциации быстро (как экспонента) возрастает с повышением температуры,
что влечет за собой резкое возрастание теплоемкости
и
степень диссоциации быстро (как экспонента) возрастает с повышением температуры,
что влечет за собой резкое возрастание теплоемкости 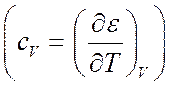 .
.
Описанный
выше подход может быть применен к любым химическим реакциям. Рассмотрим,
например, химическое равновесие реакции типа ![]() .
Типичная реакция этого типа - окисления азота
.
Типичная реакция этого типа - окисления азота ![]() , эта
реакция идет при не слишком высоких температурах
, эта
реакция идет при не слишком высоких температурах ![]() , когда
диссоциация молекул
, когда
диссоциация молекул ![]() и
и ![]() еще
мала и ею можно пренебречь. Пусть в исходной смеси содержится
еще
мала и ею можно пренебречь. Пусть в исходной смеси содержится ![]() и
и ![]() молекул
молекул
![]() и
и ![]() .
Сответствующие величины, отвечающие мгновенным значениям при заданных
.
Сответствующие величины, отвечающие мгновенным значениям при заданных ![]() и
и ![]() , есть
, есть ![]() ,
, ![]() , и продукта
реакции
, и продукта
реакции ![]() . Число молекул связаны между собой
условием сохранения числа частиц
. Число молекул связаны между собой
условием сохранения числа частиц
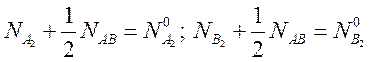 (7.34).
(7.34).
Обозначим ![]() ,
, ![]() ,
, ![]() - энергии одной молекулы, а через
- энергии одной молекулы, а через ![]() - тепловой эффект реакции – энергия,
выделяющаяся при превращениях двух молекул
- тепловой эффект реакции – энергия,
выделяющаяся при превращениях двух молекул ![]() и
и ![]() в две молекулы
в две молекулы ![]() (если
реакция идет с поглощением тепла, то
(если
реакция идет с поглощением тепла, то ![]() ). Тогда внутренняя
удельная энергия газа есть:
). Тогда внутренняя
удельная энергия газа есть:
![]() , где
, где ![]() .
.
Как и раньше,
определяя минимум свободной энергии по переменным ![]() ,
, ![]() ,
, ![]() получим:
получим:
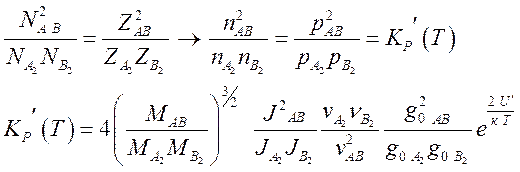 (7.35).
(7.35).
Множитель 4 в
константе равновесия возник от отношения факторов симметрии 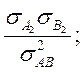 где (см. (7.16))
где (см. (7.16)) ![]()
Если газ представляет собой смесь, в которой протекает целый ряд реакции, то для каждой реакции из закона действующих масс и сохранения числа частиц можно получить формулы типа (7.35), которые образуют систему нелинейных алгебраических уравнений, определяющих химический состав. Как было показано Я. Б. Зельдовичем, эта система имеет единственное решение, то есть равновесный химический состав определяется однозначно и далее на основе выражения для свободной энергии можно рассчитать все термодинамические величины газовой смеси.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.