Для наиболее объективной оценки способов координации нитрат-иона к нитрозорутению в реальных растворах ОЯТ, геометрии образующихся комплексов и их констант устойчивости целесообразно проводить синтез и определение структуры нитроамминокомплексов нитрозорутения, образующихся в крепких азотнокислых растворах. Это связано с близостью молекул воды и аммиака по ряду характеристик – заряд, размер, дипольный момент, способность к образованию водородных связей и т.д. [5]. Руководствуясь этим принципом, Кабиным синтезировано четыре новых нитратоамминокомплекса нитрозорутения.
Транс-[RuNO(NH3)2(H2O)(NO3)2](NO3)·H2O получают растворением транс-[RuNO(NH3)2(NO2)2OH] в 3 M HNO3 при нагревании. Полученный раствор кипятят до прекращения выделения оксидов азота, после чего испаряют на водяной бане до минимального объема. К охлажденному сиропообразному раствору темно-красного цвета добавляют несколько капель воды до резкого уменьшения вязкости и оставляют при комнатной температуре. По истечению нескольких часов из раствора выделяется желтый мелкокристаллический осадок целевого комплекса [[9]].
В работе [[10]] проведено исследование кристаллической структуры транс-[RuNO(NH3)4NO3](NO3)2 методом РСА и координационного узла в гран- и ос-[RuNO(NH3)2(NO3)3] методом EXAFS. Транс-[RuNO(NH3)4NO3](NO3)2 получен при непродолжительном (~5 мин.) кипячении транс-[RuNO(NH3)4OH]Cl2 в HNO3(конц.). Гран-[RuNO(NH3)2(NO3)3] выделен в аналогичном синтезе при кипячении реакционной системы в течение часа. Выходы целевых комплексов - транс-[RuNO(NH3)4NO3](NO3)2 и гран-[RuNO(NH3)2(NO3)3] составляют 95 % и 60 % соответственно. Оба соединения имеют низкую растворимость. Полученные вещества охарактеризованы рядом физико-химических методов: РСА, РФА, ИК- и ЯМР-14N спектроскопии, ТГА (ТГ, ДТГ, ДТА) [[11]].
Ос-[RuNO(NH3)2(NO3)3] образуется наряду с транс-[RuNO(NH3)2(H2O)(NO3)2](NO3)·H2O при кипячении транс-[RuNO(NH3)2(NO2)2OH] в 3 M HNO3. Низкая растворимость ос-[RuNO(NH3)2(NO3)3] позволяет отделять его от хорошо растворимого транс-динитратодиамминокомплекса [9].
2.3. Биядерные нитрокомплексы нитрозорутения
В работе посвященной исследованию поведения транс-[Ru15NO(15NO2)4OH]2‑ в растворах H15NO3 методом ЯМР-15N авторы на основании полученных результатов предполагают, что при C(HNO3) = 0,2 М доминирующей формой нитрозорутения в таких растворах является [{RuNO(NO2)2(m-NO2)}2(m-OH)]‑ [5]. Эта димерная тринитроформа образуется в соответствии со следующим процессом:
2[RuNO(NO2)4OH]2‑ + 3H+ = [{RuNO(NO2)2(m-NO2)}2(m-OH)]‑ +
+ 2HNO2 + H2O
Не так давно, взаимодействием K2[RuNO(NO2)4OH] с разбавленной азотной кислотой при комнатной температуре была выделена в виде малорастворимой кристаллической фазы димерная тринитритная соль нитрозорутения, K2[RuNO(NO2)3(m-OH)]2 (Рис. 1, слева) [[12]].
В ряде работ, посвященных исследованию влияния цветных металлов на экстракцию рутения в форме [RuNO(NO2)4OH]2‑, обнаружено образование гетерометаллических комплексов [RuNO(NO2)4OHMLm], где M = Zn2+, Cu2+, Co2+, Ni2+; L = пиридин, трифенилфосфиноксид, три(н-бутил)фосфиноксид и m = 1-3. Получают смешением раствора Na2[RuNO(NO2)4OH]·2H2O в ацетоне и раствора Co(L)2(NO3)2 в CH2Cl2. Отфильтровывается NaNO3, а комплекс выделяется гептаном в виде мелкокристаллического осадка [[13], [14], [15]] (Рис. 1, слева).
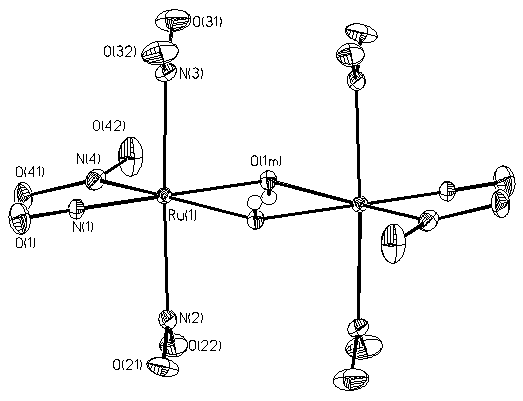
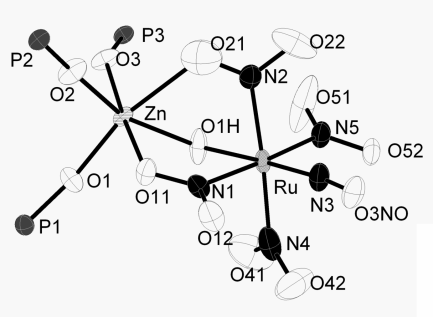
Рис.1 Фрагменты кристаллической структуры K2[RuNO(NO2)3(μ-OH)]2 (слева) и
[RuNO(NO2)4OHZn(Ph3PO)3] (справа).
3 Экспериментальная часть
3.1. Исходные реагенты, аппаратура и методы измерений
В работе использовались: дистиллированная вода, нитрит натрия х.ч., перхлорат аммония ч., нитрит калия х.ч., этиловый спирт-ректификат, диэтиловый эфир (медицинский), азотная кислота конц. ос.ч.
Использованный в работе [RuNO(NH3)4OH]Cl2 был синтезирован по методике, приведенной в работе [[16]]. Чистота вещества подтверждается данными ИК спектроскопии и рентгенофазового анализа.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.