Учитывая высокую реакционную способность солей 1,2,3-бензодитиазолия к действию нуклеофилов и неспособность их к электрофильным реакциям, можно считать, что реакция хлорирования идет в положение 6 по нуклеофильному механизму, причем акцептором гидридиона служит полухлористая сера или более слабым – хлористый тионил. Подтверждением этого служит аналогичное превращение 2-амино-4-метокситиофенола, из которого при действии хлористого тионила получен хлорид 5-метокси-1,3,2-бензодитиазолия (при кратковременном взаимодействии) и продукт его хлорирования в положение 6, которое протекает значительно легче, чем в предыдущем случае (схема 3) [4].
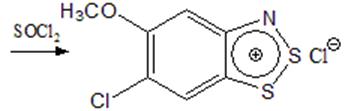

Схема 3
Однако, реакции нуклеофильного замещения идут не только по положению 6. При действии полухлористой серы на о-нитроанилин, наряду с хлорированием в п-положение, происходит вытеснение нитрогруппы атомом хлора. В работе [6] было исследовано влияние метоксильных групп в исходном нитроанилине на процесс вытеснения нитрогруппы. В реакцию Херца вводили 3-нитро-4-аминоанизол и 3-нитро-4-аминовератрол. По данным ПМР и элементарного анализа было показано, что в случае нитроаминоанизола происходит лишь частичное вытеснение нитрогруппы, причем соотношение хлорированного и нехлорированного продуктов равно примерно 2:3. В случае же нитроаминовератрола вытеснения не происходит. Т.е. введение электродонорных метоксильных групп в о-нитроанилины препятствует замещению нитрогруппы атомом хлора, что подтверждает нуклеофильный характер этой реакции. Причем, в этой работе смесь, получившуюся при пятичасовом нагревании 3-нитро-4-аминанизола с полухлористой серой в условиях реакции Херца, обработали также еще 6 часов. По данным элементного анализа, было выяснено, что в этом случае вытеснение нитрогруппы происходит полностью. При проведении же реакции в течение двух часов, получается только соединение, содержащее нитрогруппу. Эти результаты свидетельствуют о том, что при реакции с полухлористой серой сначала образуется гетерокольцо, а затем только происходит нуклеофильное замещение нитрогоруппы атомом хлора (схема 4)

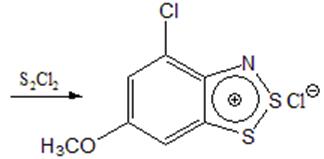
Схема 4
Ариламины замещают Cl и MeO в положении 6 карбоцикла (схема 1), образуя ярко-фиолетовые вещества, причем хлор замещается в 8 раз быстрее метоксила (схема 5) [3,7].
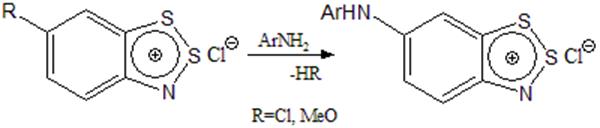
Схема 5
В работе [7] в процессе изучения реакции анилина с дизамещенными солями Херца, авторы пришли к выводу, что в дизамещенных производных в результате взаимодействия с анилином вытесняется только один заместитель, находящийся в параположении к азоту (схема 6).
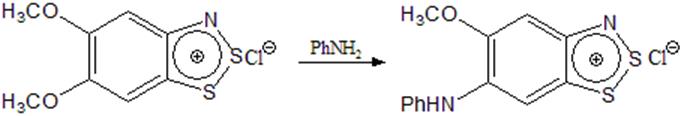
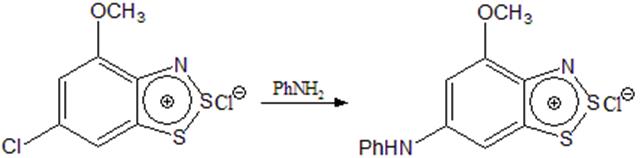
Схема 6
Все это подтверждает то, что в катионах 1,2,3-бензодитиазолия величина положительного заряда в положении 6 больше, чем в положениях 4 и 5.
При этом в тех же условиях монозамещенные соли, содержащие метоксильную группу в положении 5 или 7, в реакцию с анилином не вступали, что подтверждает механизм этой реакции.
Замещение атомов серы в соли Херца на атомы селена, особенно в положении 2, существенно усиливает степень переноса положительного заряда в бензольное кольцо, что в работе [5] связывается с меньшей способностью атома селена к образованию π-связей и локализации на нем положительного заряда. Увеличение переноса положительного заряда в конденсированное кольцо при замене атомов серы на селен увеличивает их реакционную способность в реакциях нуклеофильного замещения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.