


Кафедра физической химии
Лабораторная работа
Потенциометрическое определение коэффициентов активности соляной кислоты
В неидеальных растворах концентрация перестаёт быть величиной, однозначно характеризующей раствор. Поэтому возникает необходимость в использовании новой физической величины, называемой активностью. Активность можно назвать эффективной концентрацией, при которой идеальный раствор приобретает термодинамические свойства реального раствора. За счёт этой замены становится возможным учёт таких явлений, как эффект гидратации, взаимодействие между молекулами растворителя, гидростатическое притяжение ионов в случае электролитов. Отношение активности компонента раствора к его концентрации называют коэффициентом активности. В зависимости от способа выражения концентрации коэффициенты активности записывают по-разному:
γi = ai / mi, γi = ai / ci, γi = ai / Ni.
Активность электролита определяется произведением активности его ионов. Если молекула распадается на ν+ положительных и ν- отрицательных ионов, то активность определяется уравнением:
a=a+ν+a-ν -.
Коэффициент активности – коэффициент пропорциональности между активностью и концентрацией. Таким образом, получаем
γ+=a+/ν+m и γ-=a-/ν -m.
В растворе не могут существовать ионы только одного знака – вместе с катионом непременно присутствует анион, поэтому в качестве характеристики используют средний коэффициент активности.
γ±=(γ+ν+γ-ν -)1/(ν++ν -)
Для однозарядных катионов и анионов это выражение выглядит так.
γ±=(γ+γ-)½
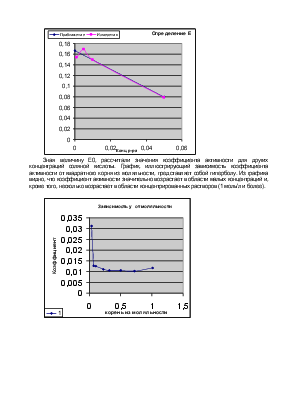
Коэффициент активности отвечает той дополнительной работе, которую следует затратить в условиях постоянства давления и температуры для преодоления силы взаимодействия при переносе 1 моля компонента идеального раствора в реальный раствор той же концентрации. Ясно, что с разбавлением раствора величина работы уменьшается и стремится к нулю при бесконечном разбавлении. Коэффициент активности при этом становится равным единице, а активность совпадает со значением концентрации. Наоборот, в концентрированных растворах работа, затрачиваемая на преодоление притяжения между отдельными заряженными частицами, становится столь значительной, что коэффициент активности превышает единицу.
Для растворителя в качестве стандартного состояния принимают состояние чистого растворителя и полагают, что его активность равна единице. Для растворённого вещества стандартным состоянием считают бесконечно разбавленный раствор, когда активность компонента оказывается равной его концентрации.
Использование коэффициента активности в уравнениях позволяет заменять величину активности произведением моляльности и среднего ионного коэффициента активности.
Широкое применение коэффициент активности получил благодаря теории Дебая-Хюккеля, которые предложили ряд формул для теоретического вычисления.
lg γi= -A * zi² *I½,
где I – ионная сила раствора, вычисляемая как полусумма произведений моляльности иона на квадрат его заряда.
I=½∑mi * zi².
A=0.434 * (2πNAms)½*V-½*e3*(4πε0εkT)-3/2 – величина, характеризующая заданную систему.
ms – масса растворителя в объёме V,
e – элементарный заряд (1.6*10-19Кл),
ε0 – диэлектрическая проницаемость вакуума (8.85*10-12 Кл²/Н*м²),
ε – диэлектрическая проницаемость растворителя.
Во втором приближении учитывают собственные размеры ионов:
lg γ± =( A*z+*z-*I½ ) / (1+aB*I½).
Строгое приближение теории Дебая – Хюккеля выражается следующим уравнением, где второй член описывает резкое возрастание коэффициентов активности, характерное для момента разрушения сольватных оболочек ионов в концентрированных растворах. Последнее слагаемое иллюстрирует отличие γN± от γm± , так как концентрация N выражена в мольных долях, а m – в моляльной шкале, причём M0 – молярная масса растворителя, а m – моляльность раствора. ν – число ионов, на которые диссоциирует электролит.
lg γ± =( A*z+*z-*I½ ) / (1+aB*I½) + C*I - lg(1+0.001νM0m).
Методы расчёта активностей.
Основное приближение состоит в том, что уравнения, справедливые для всех растворов, экстраполируют на бесконечное разбавление. При этом активности могут быть заменены измеримыми величинами.
Для неэлектролитов используют расчёт по закону распределения между несмешивающимися растворителями, расчёт по давлению пара, расчёт по известным величинам активности, расчёт по понижению температуры отвердевания.
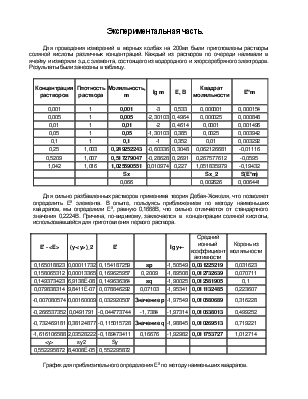
Для электролитов, кроме того, могут быть использованы расчёты по изменению растворимости соли в присутствии других солей или расчёт по методу э.д.с. Последний способ был реализован в данной работе.
Метод э.д.с. определения активностей основан на зависимости электрохимического потенциала, выражающейся в уравнении Нернста, от активностей компонентов.
E=E0 – (RT/zF)ln П aiνi .
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.