Стандартная э.д.с. – э.д.с. такого гальванического элемента, в котором активности реагентов и продуктов равны 1. В работе был использован гальванический элемент, состоящий из водородного электрода сравнения и хлорсеребряного электрода. Электролит – HCl, водные растворы различных концентраций. Изменяя концентрацию электролита, получают величины коэффициентов активности.
Уравнение процесса: 0.5 H2 gas + AgClsolid = HCl (m) + Agsolid
Уравнение Нернста в конкретном случае имеет вид (давление H2 полагают 1 атм, газ считают идеальным):
E=E0-2.303(RT/zF)lg m²γ±², откуда E=E0-0.1183Cm, С – некоторая константа.
Для того, чтобы определить величину коэффициента активности, сначала рассчитывают величину E0, пользуясь положением теории Дебая-Хюккеля для сильно разбавленных растворов: концентрацию порядка 10-³ считают очень малой. Тогда коэффициент активности близок к 1, а активность можно считать равной концентрации. Из показаний вольтметра и значения моляльности рассчитывают E0.
После этого, зная величину E0, проводят измерения электрохимического потенциала растворов известной моляльности и рассчитывают значения коэффициентов активности.
E+ 0.1183 lg m = E0 – 0.1183 lg γ±
Экспериментальная часть.
Для проведения измерений в мерных колбах на 200мл были приготовлены растворы соляной кислоты различных концентраций. Каждый из растворов по очереди наливали в ячейку и измеряли э.д.с элемента, состоящего из водородного и хлорсеребряного электродов. Результаты были занесены в таблицу.
|
Концентрация растворов |
Плотность раствора |
Моляльность, m |
lg m |
E, В |
Квадрат моляльности |
E'*m |
|
0,001 |
1 |
0,001 |
-3 |
0,533 |
0,000001 |
0,000154 |
|
0,005 |
1 |
0,005 |
-2,30103 |
0,4964 |
0,000025 |
0,000848 |
|
0,01 |
1 |
0,01 |
-2 |
0,4614 |
0,0001 |
0,001496 |
|
0,05 |
1 |
0,05 |
-1,30103 |
0,385 |
0,0025 |
0,003942 |
|
0,1 |
1 |
0,1 |
-1 |
0,352 |
0,01 |
0,003292 |
|
0,25 |
1,003 |
0,249252243 |
-0,60336 |
0,3048 |
0,062126681 |
-0,01116 |
|
0,5209 |
1,007 |
0,517279047 |
-0,28628 |
0,2691 |
0,267577612 |
-0,0595 |
|
1,042 |
1,016 |
1,025590551 |
0,010974 |
0,227 |
1,051835979 |
-0,19432 |
|
Sx |
Sx_2 |
S(E*m) |
||||
|
0,066 |
0,002626 |
0,006441 |
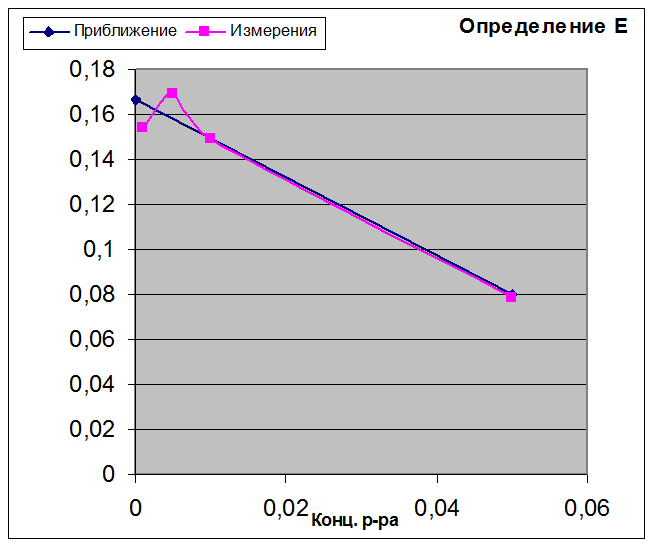
Для сильно разбавленных растворов применима теория Дебая-Хюккеля, что позволяет определить E0 элемента. В опыте, пользуясь приближением по методу наименьших квадратов, мы определили E0, равную 0,1668В, что сильно отличается от стандартного значения 0,2224В. Причина, по-видимому, заключается в концентрации соляной кислоты, использовавшейся для приготовления первого раствора.
|
E' - <E> |
(y-<y>)_2 |
E' |
lg y+- |
Средний ионный коэффициент активности |
Корень из моляльности |
|
|
0,165018823 |
0,00011732 |
0,154187259 |
sp |
-1,50549 |
0,031225219 |
0,031623 |
|
0,158065312 |
0,00013365 |
0,169625957 |
0,2009 |
-1,89508 |
0,012732639 |
0,070711 |
|
0,149373423 |
6,9138E-08 |
0,149636364 |
sq |
-1,90025 |
0,012581905 |
0,1 |
|
0,079838314 |
9,8411E-07 |
0,078846292 |
0,07103 |
-1,95341 |
0,011132485 |
0,223607 |
|
-0,007080574 |
0,00160009 |
0,032920507 |
Значение p |
-1,97549 |
0,010580689 |
0,316228 |
|
-0,266537352 |
0,0491791 |
-0,044773744 |
-1,7384 |
-1,97314 |
0,010638013 |
0,499252 |
|
-0,732469181 |
0,38124877 |
-0,115015728 |
Значение q |
-1,98845 |
0,010269513 |
0,719221 |
|
-1,616106588 |
2,03528222 |
-0,189473411 |
0,16676 |
-1,92982 |
0,011753727 |
1,012714 |
|
<y> |
sy2 |
Sy |
||||
|
0,552295872 |
8,4008E-05 |
0,552295872 |
График для приблизительного определения E0 по методу наименьших квадратов.
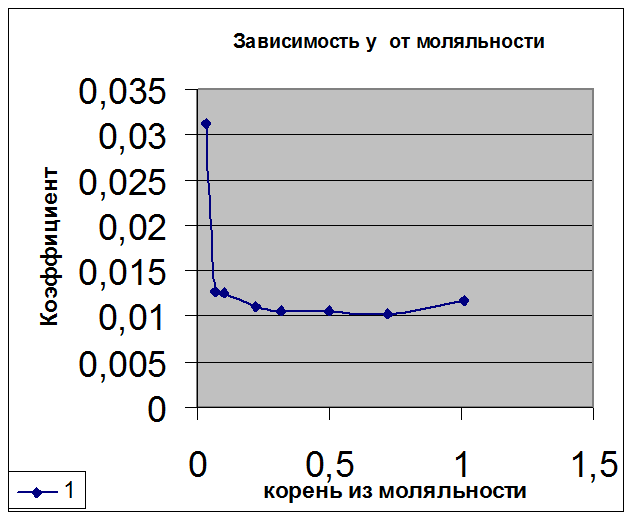
Зная величину E0, рассчитали значения коэффициента активности для других концентраций соляной кислоты. График, иллюстрирующий зависимость коэффициента активности от квадратного корня из моляльности, представляет собой гиперболу. Из графика видно, что коэффициент активности значительно возрастает в области малых концентраций и, кроме того, несколько возрастает в области концентрированных растворов (1 моль/л и более).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.