Таким образом, уравнение (8) содержит две неизвестные величины: Е0 и γ± . Их можно определить измеряя э.д.с. элемента в некотором интервале концентраций соляной кислоты, включающем область разбавленных растворов, где применима теория Дебая-Хюккеля. Преобразуя уравнение (8) и подставляя для температуры значение 25°С (стандартные условия), получаем:
Е + 0,1183 lg (m) = E0 – 0,1183 lg(γ±) (9)
Воспользуемся третьим приближением теории Дебая-Хюккеля:
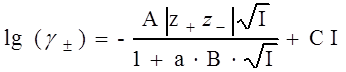 |
(10)
где I – ионная сила; z+ и z ‑ - заряды катиона и аниона соответственно; a – величина, соответствующая наибольшему расстоянию, до которого могут сближаться электрические центры двух ионов; С – эмпирическая константа, лишенная какого-либо физического смысла; величины А и В можно вычислить по следующим формулам:
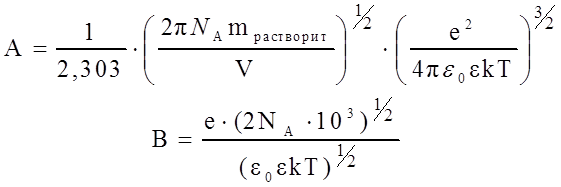 |
(11)
где mрастворит – масса растворителя в объеме V; е – заряд электрона; e0 – диэлектрическая проницаемость вакуума; e - диэлектрическая проницаемость используемого растворителя. Известно, что для воды произведение В . а = 1. Подставляя значения постоянных в уравнение (11) для воды при 25°С, получаем константу А:
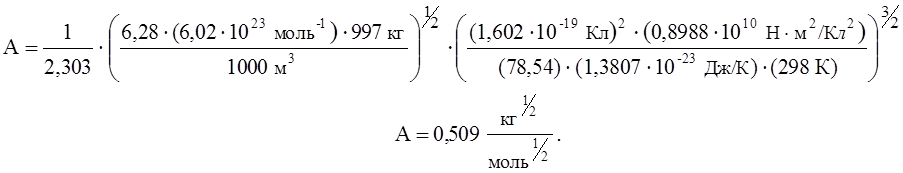 |
(12)
Тогда мы можем получить явную зависимость коэффициента активности от концентрации. Используя (10), (11) и (12) получим выражение для lg γ± :
lg (γ±) = -0.509(m)1/2/[1 + (m)1/2] +C.m (13)
Подставляя (13) в уравнение (9) и группируя по другому члены, получим:
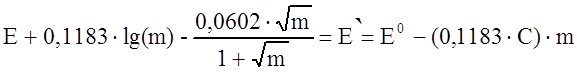 |
(14)
График зависимости левой части уравнения (14), которую мы обозначили как Е’, от m представляет собой прямую линию, а и при m = 0 мы получаем значение Е0.
После того, как значение Е0 найдено, можно рассчитать значение коэффициентов активности соляной кислоты при любой концентрации по измеренной э.д.с. элемента, содержащего соляную кислоту при этой концентрации.
2.Экспериментальная часть.
|
CHCl,моль/л |
mHCl, моль/кг |
Е, В |
E', В |
|
0.001 |
,001 |
0,585 |
0,228255 |
|
0.005 |
0,005 |
0,4958 |
0,219812 |
|
0.01 |
0,01 |
0,4612 |
0,219127 |
|
0.02 |
0,02 |
0,420 |
0,211553 |
|
0.05 |
0,05 |
0,3838 |
0,218887 |
|
0.07 |
0,07 |
0,3674 |
0,21818 |
|
0.1 |
0,1 |
0,3505 |
0,217737 |
|
0.52 |
0,517 |
0,2685 |
0,209426 |
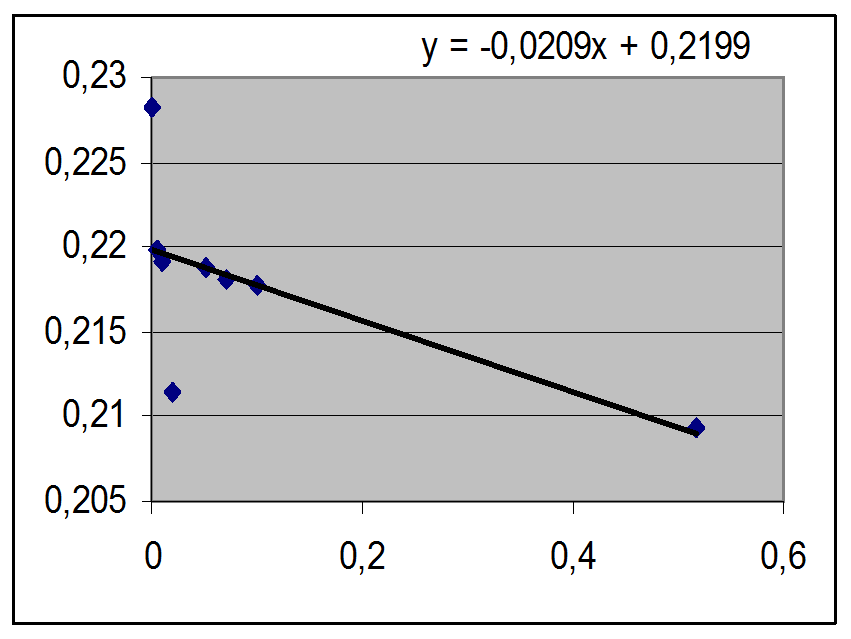
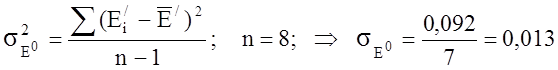 |
|
E1 |
Lg(γ) |
γ |
|
0,585 |
-0,08622 |
0,917391 |
|
0,496 |
-0,03287 |
0,967667 |
|
0,4612 |
-0,03973 |
0,961049 |
|
0,42 |
0,007508 |
1,007536 |
|
0,3838 |
-0,08443 |
0,919035 |
|
0,3674 |
-0,09193 |
0,912171 |
|
0,3505 |
-0,10397 |
0,90125 |
|
0,2685 |
-0,12431 |
0,883106 |
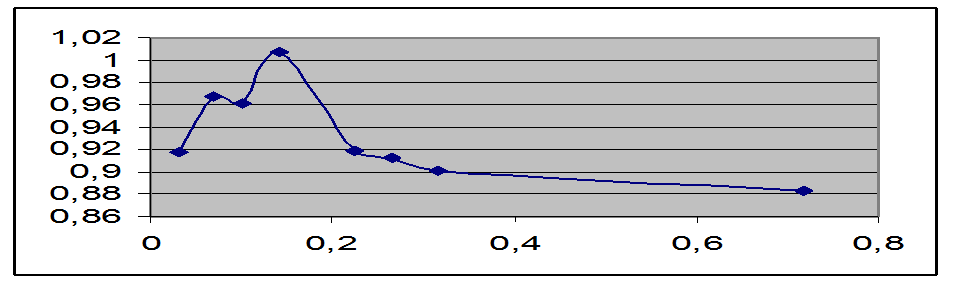
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.