Новосибирский государственный университет
Министерство общего и профессионального образования.
Кафедра физической химии.
Курсовая работа по химической кинетике.
Тема: Определение константы скорости реакции окисления оксида азота кислородом воздуха
Выполнили:
Кузнецов П.П.
Никульшин П.В.
Руководитель
Калинкин П. Н.
Новосибирск 2004
Цель работы: изучение кинетики реакции окисления оксида азота кислородом, определение порядка реакции по NO.константы скорости реакции и оценка её по теории активированного комплекса.
Литературный обзор.
Для того чтобы произошел тримолекулярный элементарный акт, необходимо, чтобы произошло соударение трех частиц. Строго одновременное соударение трех частиц имеет нулевую вероятность и во всех случаях какие-то две из трех соударяющихся частиц встретятся несколько раньше, чем к ним приблизиться третья частица. Поэтому тримолекулярные реакции можно рассматривать как сложный процесс, состоящий из двух бимолекулярных стадий. На первой стадии из двух частиц А1 и А2 образуется промежуточная частица А1А2. Далее эта частица реагирует с молекулой А3 с образованием продуктов реакции.
Если промежуточная частица представляет собой лабильное образование с малой продолжительностью жизни и между А1 и А2 не возникает никаких прочных химических связей, то первая стадия, подобно процессу активации в случае мономолекулярных реакций, не является химическим превращением и весь процесс можно рассматривать как единый элементарный химический процесс.
Пусть на протяжении всего процесса соблюдается равенство скоростей образования частиц А1А2 и их обратного распада на А1 и А2 (то есть имеет место равновесие между А1А2 и А1,А2):
![]() .
.
Здесь k1,2 – константа скорости образования, а k12 – константа скорости ее распада. Величины С1 и С2 – концентрации свободных (не связанных в комплекс) частиц А1 и А2. Поскольку речь идет о лабильных промежуточных частицах А1А2, то их концентрация мала по сравнению с С1 и С2 и, следовательно, в дальнейшем можно считать, что С1 и С2 практически совпадают с полными концентрациями А1 и А2 в системе.
Если обозначить через k12,3 константы скорости реакции А1А2 с А3, то скорость образования продуктов реакции в результате этого процесса будет описываться уравнением
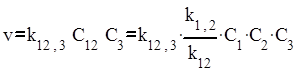 .
.
Так как реакция может осуществляться также при взаимодействии А1 с промежуточной частицей А2А3 или А2 с промежуточной частицей А3А1, суммарная скорость реакции по любому из возможных путей равна
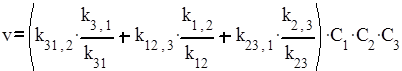 .
.
Таким образом, тримолекулярная реакция оказывается реакцией третьего порядка с константой скорости
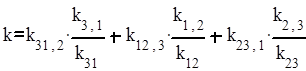 .
.
Константы скорости отдельных бимолекулярных стадий можно выразить через факторы соударений, стерические факторы и энергии активации, а константы скорости мономолекулярных реакций – через предэкспоненциальные множители и энергии активации. При этом получается следующее выражение для константы скорости третьего порядка:
|
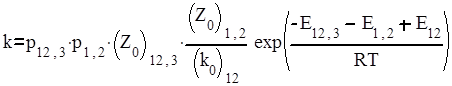
|
|
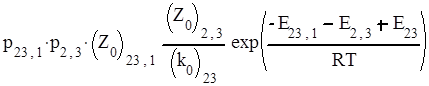
|
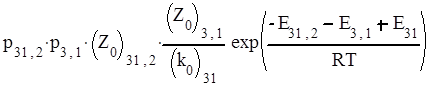 .
.
Поскольку Е1,2 и – энергии активации прямой и обратной стадий, то Е1,2 - Е12 представляют собой тепловой эффект образования А1А2, то есть Q12. Следовательно, Е12,3 + Q12 представляет собой высоту потенциального барьера реакций по отношению к исходным частицам А1, А2, А3, то есть является потенциальным барьером Е всего процесса:
Е = Е12,3 + Е1,2 – Е12.
Аналогично
Е = Е23,1 + Е2,3 – Е23 Е = Е31,2 + Е3,1 – Е31.
Так как р1,2 есть вероятность взаимной ориентации А1 и А2, необходимой для протекания реакции, а р12,3 – вероятность необходимой взаимной ориентации частицы А1А2 и частицы А3 , то произведение этих величин есть вероятность необходимой взаимной ориентации всех трех частиц. Аналогичный смысл имеют произведения р2,3р23,1 и р3,1р31,2. поэтому можно считать, что
р3,1р31,2 = р2,3р23,1 = р1,2р12,3 = р,
где р – стерический фактор тримолекулярной реакции. Поэтому приведенную выше константу можно записать в виде
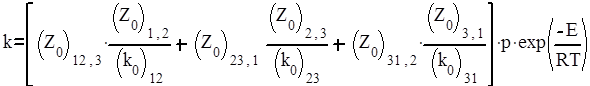 .
.
Величина
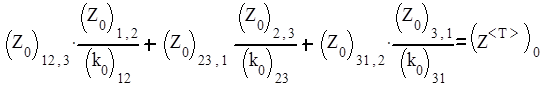
есть фактор соударений тримолекулярной реакции. Поскольку Z0 имеет значение 10-16 - 10-17 м6с-1, а предэкспоненцальный множитель мономолекулярной реакции равен 10-13 с-1, то фактор соударений тримолекулярной реакции Z0(Т) оказывается величиной, равной 10-45 – 10-47 м6с-1. Соответственно в единицах молярности Z0(Т) в (6,02*1026)2 раз большей является величиной порядка 106 – 108 М-2с-1.
Выражение для скорости тримолекулярной реакции может быть записано в виде
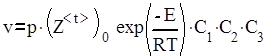 ,
,
а константа скорости
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.