


НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Задача С – 3
Определение константы диссоциации бромтимолового синего по спектроскопическим данным
Выполнили:
Кабин Е.В.
Баяндин П.В.
26 ноября 2005 г
Поглощение света зависит от природы вещества и от длины волны.
D=lg(Joλ/Jλ), где Joλ – интенсивность падающего света, Jλ – интенсивность выходящего света. D=ελ*C*l, где ελ – мольный коэффициент экстинкции, C – молярная концентрация, l - толщина раствора в кювете. ελ зависит от свойств молекулы, природы растворителя, температуры и длины волны, как правило, не зависит от концентрации. Закон Бэра: Поглощение света в тонком слое пропорционально концентрации поглощающих свет частиц.εА-=Dщел./C0*l; εАH=Dкисл./C0*l; C0 – аналитическая концентрация вещества. α=CA-/C0= Dкисл.-D/ Dкисл.- Dщел. – степень диссоциации.
Константа диссоциации кислоты НА равна константе равновесия реакция:
К=( сA-* сН+/ сAH)*( fA-* fН+/ fAH).
lg f+=-0,509*√I/(1+√I), где I=0,5∑сi* zi2
lg K=lg (α/1-α)-pH+lg f+.
В работе используют следующие растворы:
- Исходные готовые растворы (приготовленные лаборантом)
- Буферные растворы (готовят студенты)
- Рабочие растворы (готовят студенты)
|
Растворённое вещество |
Концетрация |
|
БТС HCl NaOH Стандартный фосфатный буфер (буфер 1) |
1,0 г/л 0,1 М 0,1 М pH = 6,86 |
Готовят в стаканчике на 50 мл из буфера 1, добавляя по каплям раствор NaOH. Значение pH контролируют по иономеру «Анион-4100»
Раствор БТС с концентрацией 0,2 г/л готовят в мерной колбе объёмом 50 мл. Из этих растворов готовят следующие рабочие растворы в мерных колбах на 50 мл (доводят до метки водой) :
№1 8 мл БТС + 5 мл HCl
№2 6 мл БТС + 5 мл HCl
№3 4 мл БТС + 5 мл HCl
№4 2 мл БТС + 5 мл HCl
№5 4 мл БТС+5 мл NaOH
№6 2 мл БТС+5 мл NaOH
№7 1 мл БТС+5 мл NaOH
№8 0,5 мл БТС+5 мл NaOH №9
№9 4 мл БТС+5 мл буфера 1
№10 4 мл БТС+5 мл буфера 2
|
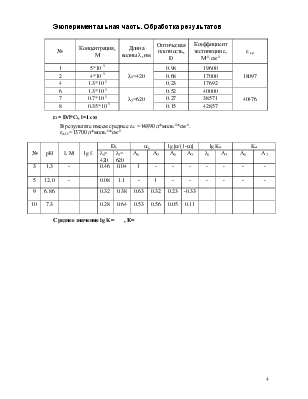
№ |
Концентрация, М |
Длина волны l, нм |
Оптическая плотность, D |
Коэффициент экстинкции e, М-1×см-1 |
e ср |
|
1 |
5*10-5 |
l1=420 |
0.98 |
19600 |
18097 |
|
2 |
4*10-5 |
0.68 |
17000 |
||
|
4 |
1.3*10-5 |
0.23 |
17692 |
||
|
6 |
1.3*10-5 |
l2=620 |
0.52 |
40000 |
40476 |
|
7 |
0.7*10-5 |
0.27 |
38571 |
||
|
8 |
0.35*10-5 |
0.15 |
42857 |
εi = D/l*Ci, l=1 cм
В результате имеем среднее εА- =14890 л*моль-1*см-1.
εАН.=13700 л*моль-1*см-1
|
№ |
pH |
I, M |
lg f- |
Dλ |
aλ |
lg{α/(1-α)} |
lg Ka |
Ka |
|||||
|
λ1= 420 |
λ2= 620 |
Λ1 |
Λ2 |
Λ1 |
Λ2 |
λ1 |
Λ2 |
Λ1 |
Λ2 |
||||
|
3 |
1,3 |
- |
0.46 |
0.04 |
1 |
- |
- |
- |
- |
- |
- |
- |
|
|
5 |
12,0 |
- |
0.08 |
1.1 |
- |
1 |
- |
- |
- |
- |
- |
- |
|
|
9 |
6.86 |
0.32 |
0.38 |
0.63 |
0.32 |
0.23 |
-0.33 |
||||||
|
10 |
7.3 |
0.28 |
0.64 |
0.53 |
0.56 |
0.05 |
0.11 |
||||||
Среднее значение lg K= , К=
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.