Общим недостатком данной теории является её ограниченная применимость. Всё вышесказанное справедливо только для начальных скоростей реакций. Кроме того, существуют аллостерические ферменты. Кинетика химических реакций с их участием отличается от кинетики ферментативных реакций Михаэлиса-Ментен.
Свойства глюкозы
Глюкоза с точки зрения химика представляет соединение, в котором присутствуют свойства альдегида и многоатомного спирта, и относится к классу углеводов. Природным сахаром является D-глюкоза. Её L-аналог получен синтетически. Отличие между ними заключается во вращении плоскости поляризованного света в разные стороны (D – вправо, L - влево).
В растворе реализуется сложное равновесие между разными конформациями молекулы. Открытой формы в смеси, как правило, очень немного, значительно преобладают две циклические – α и β. В зависимости от растворителя из раствора кристаллизуется либо α (H2O, CH3OH; угол вращения +112°), либо β (C5H5N, CH3COOH; угол вращения +19°) формы [4].
![]()
![]()
|
|
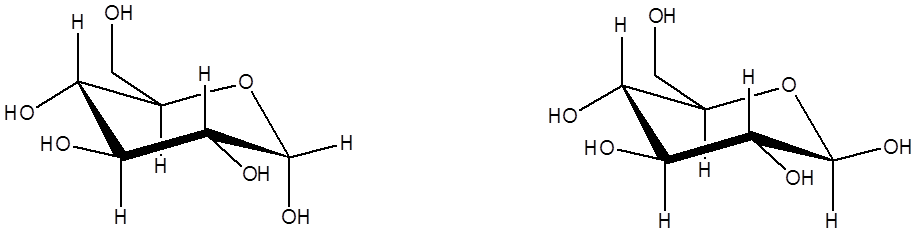
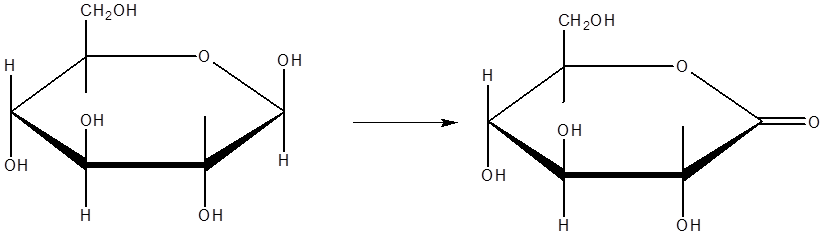
Глюкоза легко окисляется по первому атому углерода (показано стрелкой).
Ферментативное окисление глюкозы кислородом под действием глюкозооксидазы.
В данной работе перед нами стояла задача определить максимальную скорость и константу Михаэлиса для реакции ферментативного окисления глюкозы. Побочным продуктом реакции окисления β-D-глюкозы является пероксид водорода.
|
|
|
Для измерений нами была использована методика, описанная в [5]. Скорость реакции может быть рассчитана, если известно изменение концентрации реагента или продукта за некоторое время. Определение концентрации растворённого вещества можно осуществить спектрофотометрическим методом, если вещество поглощает в данной области спектра и его сигнал можно идентифицировать среди прочих.
В нашей работе определение концентрации проводилось косвенным путём за счёт реакции продукта окисления глюкозы H2O2 с иодидом калия. При этом по умолчанию считалось, что вторая реакция протекает намного быстрее, чем анализируемая, и отсутствуют побочные реакции восстановления пероксида водорода.
Смешение реагентов проходило непосредственно в кювете прибора. В качестве фона использовали буферный раствор с pH=6.00, приготовленный из однозамещённого фосфорнокислого калия KH2PO4.
Методика эксперимента состояла в том,
что выделяющийся в реакции окисления глюкозы пероксид водорода вводили в
реакцию с раствором иодида калия: ![]() Образующийся анион
Образующийся анион ![]() имеет интенсивный максимум поглощения при
350 нм, который регистрируется спектрофотометром. На приборе установили длину
волны 2860см-1, что соответствует частоте ≈8,58*1014
Гц, или длине волны 350нм.
имеет интенсивный максимум поглощения при
350 нм, который регистрируется спектрофотометром. На приборе установили длину
волны 2860см-1, что соответствует частоте ≈8,58*1014
Гц, или длине волны 350нм.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы реагентов.
Раствор KH2PO4 был приготовлен растворением навески 1.7063г в 200мл воды. Значение pH раствора отрегулировали посредством pH-метра, добавляя по каплям водный раствор NaOH. Приготовленный раствор количественно перенесли в мерную колбу на 250,0 мл, довели до метки водой и использовали в качестве буферного в эксперименте.
Раствор иодида калия приготовлен растворением навески 0,8295г в 8мл буфера. К полученному раствору добавили 2 мл 9% раствора молибдата натрия Na2MoO4. Был получен раствор иодида калия с концентрацией 0,4997моль/л.
Раствор β-D-глюкозы был приготовлен навески 1,0002г в 10мл буфера. Концентрация раствора 0,5556 моль/л.
Эксперимент.
В кварцевую кювету спектрофотометра длиной 1см вносили заданные количества реагентов, потом добавляли раствор глюкозооксидазы (10мкл), перемешивали и записывали график интенсивности поглощения от времени.
Каждый опыт повторяли не менее двух раз для получения правильных результатов и уменьшения случайной ошибки. После этого изменяли концентрацию β-D-глюкозы (субстрата) в пробе и вновь проводили измерения.
Прибором
регистрировалась увеличение оптической плотности во времени, что говорило об
увеличении концентрации ![]() в анализируемом
растворе. Изменение концентрации поглощающего вещества можно рассчитать
согласно закону Бугера-Ламберта-Бэра из изменения оптической плотности
раствора.
в анализируемом
растворе. Изменение концентрации поглощающего вещества можно рассчитать
согласно закону Бугера-Ламберта-Бэра из изменения оптической плотности
раствора. ![]() . Величина коэффициента экстинкции
. Величина коэффициента экстинкции ![]() на данной длине волны была нам известна
(2,5*104 л/(моль*см)). Из величины временной развёртки (4,4мин) было
определено время каждого опыта, что позволило рассчитать скорость превращения.
Среднюю скорость определяли как среднее арифметическое результатов каждого
опыта. В таблице приведена скорость ферментативной реакции в расчёте на 1мкл
фермента.
на данной длине волны была нам известна
(2,5*104 л/(моль*см)). Из величины временной развёртки (4,4мин) было
определено время каждого опыта, что позволило рассчитать скорость превращения.
Среднюю скорость определяли как среднее арифметическое результатов каждого
опыта. В таблице приведена скорость ферментативной реакции в расчёте на 1мкл
фермента.
Результаты занесли в таблицу.
Таблица 1
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.