Занятие 3. Количественное определение содержания глюкозы в крови глюкозооксидазным методом.
Приборы и материалы:
1) фотоэлектроколориметр;
2) 3 мм кюветы;
3) пробирки;
4) термостат (37°С);
5) мерные колбы;
6) центрифуга;
7) мерные пробирки на 10 мл;
8) глюкоза;
9) пипетки на 1 и 5 мл;
10) депротеинирующий реактив (0,2 М хлорнокислый литий в 0,9%-ном растворе хлористого натрия;
11) ферментативный реагент, содержащий: 9 ед. акт. глюкозооксидазы, 0,7 ед. акт. пероксидазы, 1 ммоль 4-аминоантипирина, 0,0076 ммоль фенола в 1 мл 0,1 мМ фосфатного буфера рН 7,0. (Растворы 10 и 11 – из набора реактивов «Новоглюк» ЗАО «Вектор-Бест»).
Экспериментальная часть
Обезглавить крысу. Стекающую кровь собрать в пробирку с депротеинирующим реактивом (из расчета 5 мл депротеинерующего реактива на 0,5 мл крови). Полученный раствор быстро перемешать стеклянной палочкой и перелить в центрифужную пробирку. Центрифугировать 10 мин при 2000 об/мин. Супернатант аккуратно перенести пипеткой в чистую пробирку.
Для построения калибровочной кривой в мерной колбе приготовить раствор глюкозы с концентрацией 12 ммоль/л. Далее из него получить растворы с концентрациями 3 ммоль/л, 6 ммоль/л и 9 ммоль/л.
Приготовленные растворы глюкозы разбавить точно так же, как и кровь (исключая процедуру центрифугирования), но вместо депротеинирующего реактива использовать дистиллированную воду. Для этого в четыре пробирки внести по 5 мл воды и 0,5 мл соответствующего раствора глюкозы.
Для определения концентрации глюкозы в шесть пробирок внести по 3 мл ферментативного реагента, поместить их в термостат (37°С) на 5 мин, затем в четыре из них добавить по 0,3 мл разбавленного, как описано выше, раствора глюкозы (для построения калибровочной кривой). В пятую пробирку добавить 0,3 мо полученного из крови супернатанта, в шестую – 0,3 мо воды (контрольная проба). Растворы перемешать и выдержать в течение 25 мин при 37°С.
По истечении времени измерить оптическую плотность против воздуха (λ = 490 нм, кювета 3 мм). Окраска стабильна в течение 1 часа.
|
Номер раствора |
Концентрация глюкозы, ммоль/л |
Оптическая плотность |
|
1 |
3 |
0,12 |
|
2 |
6 |
0,15 |
|
3 |
9 |
0,22 |
|
4 |
12 |
0,33 |
|
5 |
? |
0,0775 |
|
6 (контроль) |
0 |
0,0725 |
По полученным данным построить калибровочную кривую в координатах: оптическая плотность-концентрация глюкозы в ммоль/л. Используя кривую, найти концентрацию глюкозы в крови крысы.
Калибровочная кривая
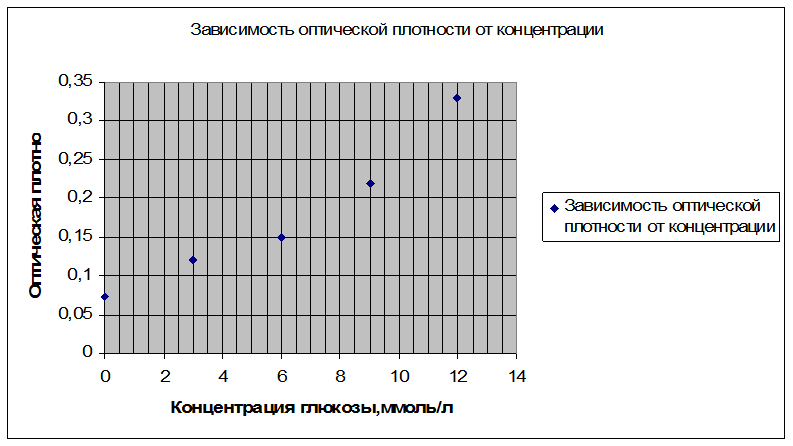
Используя калибровочную кривую, найти концентрацию глюкозы в крови крысы. Она составила 0,6 ммоль/л.
Занятие 4. Количественное определение неорганического фосфата. Использование неорганического фосфата в метаболизме дрожжей
Приборы и материалы:
1) фотоэлектроколориметр;
2) 3 мм кюветы;
3) пробирки химические – 10 шт.;
4) термостат (37°С);
5) ледяная баня (0°С);
6) центрифуга;
7) пробирки центрифужные – 4 шт.;
8) секундомер;
9) пипетки на 200 мкл, 1 мл и 5 мл;
10) стеклянная палочка.
Реактивы:
1) сухие дрожжи;
2) глюкоза;
3) фосфатная смесь (60 мг Na2HPO4 • 12H2O + 20 мг KH2PO4 на 1 л Н2О)
4) стандартный раствор фосфата 0,1 мМ (15,6 мг NaH2PO4 • 2H2O на 1 л Н2О);
5) 10%-ая трихлоруксусная кислота (ТХУ);
6) 1%-й раствор тритона Х-100;
7) 2,5%-й раствор молибдата аммония (2,5 г (NH4)6Mo7O24 • 4H2O в 100 мл 3М H2SO4).
Экспериментальная часть
а) Метаболизм дрожжей
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.