|
Номер пробы |
Концентрация белка, мкг/мл |
Оптическая плотность, (λ = 670 нм, кювета 10 мм) |
|
1(контроль) |
0 |
0,17 |
|
2 |
100 |
0,6 |
|
3 |
75 |
0,32 |
|
4 |
50 |
0,28 |
|
5 |
25 |
0,22 |
|
6 |
10 |
0,195 |
|
7(задача) |
? |
0,43 |
Калибровочная кривая
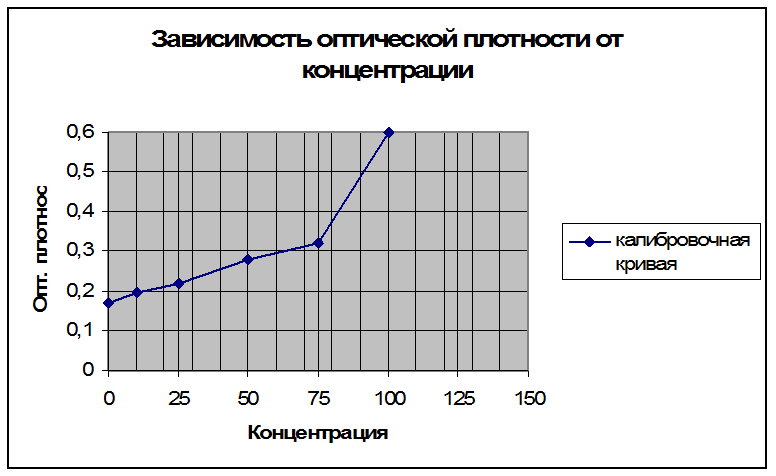
Рассчитанная концентрация белка в ткани с учетом всех разведений составила 156 мкг/мл.
Занятие 9. Определение активности щелочной фосфатазы
Приборы и реактивы:
1) фотоэлектроколориметр;
2) 10 мм кюветы;
3) пробирки;
4) пипетки на 1, 2 и 5 мл;
5) термостат (30°С);
6) весы технические;
7) секундомер;
8) гомогенизатор;
9) чашка Петри, лед;
10) ножницы.
Реактивы:
1) 5,5 мМ раствор n-нитрофенилфосфата в 0,05 М глициновом буфере рН 10,0, содержащем 5 мМ MgSO4;
2) 0,01 М глициновый буфер рН 10,0;
3) 0,02 М раствор NaOH.
Экспериментальная часть
а) Приготовление гомогената почек крысы
Крысу забить декапитацией, извлечь почки,
взвесить их, поместить в чашку Петри (поставленную на лед) и тщательно
измельчить ножницами. Измельченную почку суспендировать в четырех объемах (в мл
по отношению к весу ткани в г) охлажденного до 0°С 0,01 М глицинового буфера рН 10,0. Суспензию перенести в гомогенизатор, помещенный в ледяную баню, и
гомогенизировать до однородного состояния. Гомогенат хранить при 0°С. Для
определения активности щелочной фосфатазы использовать гомогенат почек,
разбавленный в 10 раз охлажденным до 0°С 0,01 М глициновым буфером рН 10,0.![]()
б) Определение активности щелочной фосфатазы при 30°С в гомогенате почек крысы.
Поместить пробирку с 5 мл 5,5 мМ раствора n-нитрофенилфосфата в термостат (30°С, 10 мин). После этого внести в пробирку 0,5 мл гомогената почек (разбавленного) и включить секундомер. Через 5, 10, 15, 20 и 30 мин от начала реакции из реакционной смеси отобрать пробы по 1 мл и быстро перенести в заранее приготовленные пробирки с 10 мл 0,02 М NaOH. Измерить против воздуха оптическую плотность (λ = 400 нм, кювета 10 мм) этих растворов, а так же контрольного раствора, содержащего 11 мл 0,02 М NaOH, 1 мл 5,5 мМ n-нитрофенилфосфата и 100 мкл разбавленного гомогената (компоненты смешивать в указанной последовательности). Результаты измерений занести в таблицу.
|
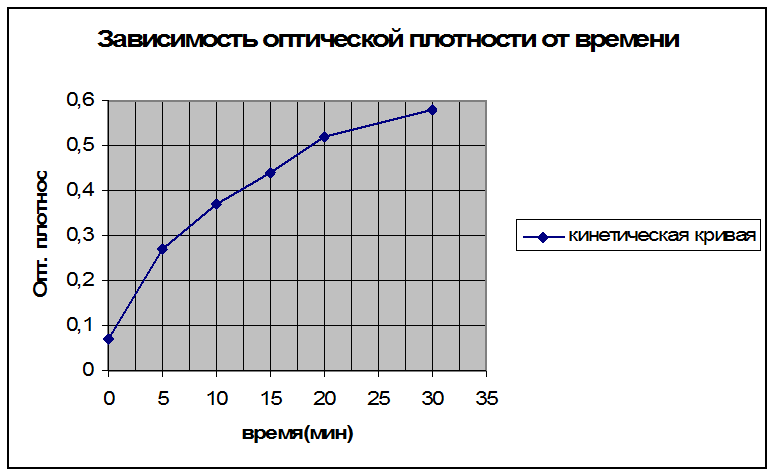
Время реакции, мин |
0(контроль) |
5 |
10 |
15 |
20 |
30 |
|
D400 |
0,07 |
0,27 |
0,37 |
0,44 |
0,52 |
0,58 |
Построить график в координатах D400 от t.
По начальному линейному участку кинетической кривой рассчитать скорость реакции:
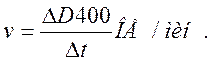
Скорость реакции равна 0,04 ОЕ/мин.
Рассчитать активность щелочной фосфатазы Е на 1 мл гомогената почек:
![]() Е/мл гомогената почек =
Е/мл гомогената почек = 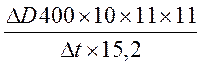 мкМ/мин,
мкМ/мин,
где 15,2 – оптическая плотность 1мМ раствора n-нитрофенола.
Активность щелочной фосфатазы равна 3,18 мкМ/мин.
Занятие 10. Исследование свойств щелочной фосфатазы
Приборы и реактивы:
1) фотоэлектроколориметр;
2) 10 мм кюветы;
3) пробирки;
4) пипетки на 1, 2 и 5 мл;
5) термостат (30°С);
6) ледяная баня;
7) секундомер.
Реактивы:
1) 5,5 мМ раствор n-нитрофенилфосфата в 0,05 М глициновом буфере рН 8,0, содержащем 5 мМ MgSO4;
2) 5,5 мМ раствор n-нитрофенилфосфата в 0,05 М глициновом буфере рН 10,0, содержащем 5 мМ MgSO4;
3) 5,5 мМ раствор n-нитрофенилфосфата в 0,05 М глициновом буфере рН 12,0, содержащем 5 мМ MgSO4;
4) 0,02 М раствор NaOH;
5) раствор щелочной фосфатазы из кишечника цыплят с активностью 0,1 ед. акт./мл в 0,01 М глициновом буфере рН 10,0, содержащем 1%-й тритон Х-100 (хранить в процессе работы на ледяной бане).
Экспериментальная часть
а) Зависимость активности щелочной фосфатазы от рН среды
Поместить пробирку с 5 мл 5,5 мМ раствора n-нитрофенилфосфата ( в буфере рН 8,0, 10,0 или 12,0) в термостат (30°С, 10 мин). После этого внести в пробирку 0,5 мл раствора фермента и включить секундомер. Через 5, 10, 20, 30 и 40 мин от начала реакции из реакционной смести отобрать пробы по 1 мл и быстро перенести в заранее приготовленные пробирки с 10 мл 0,02 М NaOH. Измерить против воздуха оптическую плотность (λ = 400 нм, кювета 10 мм) этих растворов, а также контрольного раствора, содержащего 11 мл 0,02 М NaOH, 1 мл 5,5 мМ n-нитрофенилфосфата и 100 мкл раствора фермента (компоненты смешивать в указанной последовательности). Результаты занести в таблицу.
|
Время, мин |
Оптическая плотность D400 |
||
|
рН 8,0 |
рН 10,0 |
рН 12,0 |
|
|
0(контроль) |
0,1 |
0,1 |
0,095 |
|
5 |
0,12 |
0,32 |
0,33 |
|
10 |
0,16 |
0,465 |
0,46 |
|
20 |
0,2 |
0,72 |
0,67 |
|
30 |
0,26 |
0,87 |
0,84 |
|
40 |
0,31 |
0,95 |
0,9 |
Далее на одном графике в координатах D400 от t начертить все кинетические кривые.
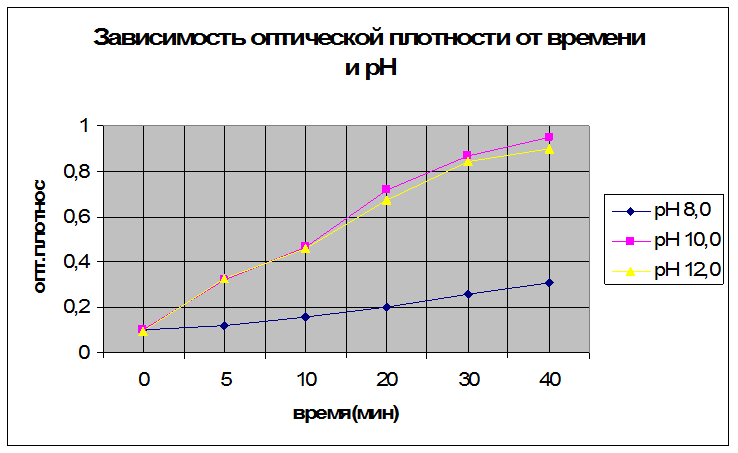
По начальным линейным участкам кинетических кривых вычислить скорость реакции:
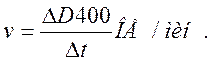
Рассчитанная скорость:
При рН 8,0: 0,02 ОЕ/мин;
При рН 10,0: 0,064 ОЕ/мин;
При рН 12,0: 0,066 ОЕ/мин.
Построить график зависимости скорости реакции от рН и определить оптимальное значение рН для реакции гидролиза n-нитрофенилфосфата фосфатазой.
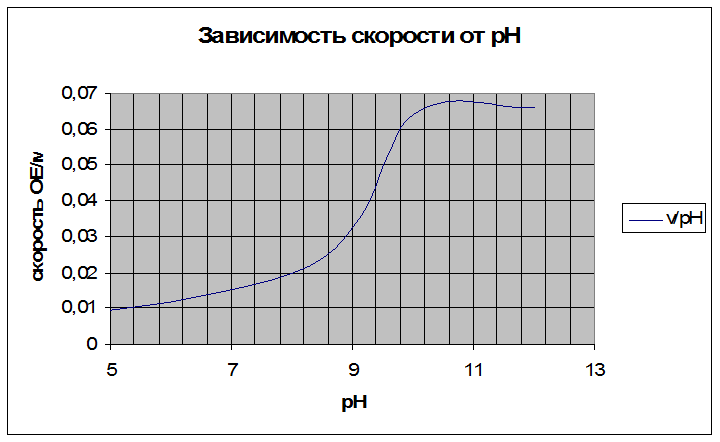
Оптимальное значение рН около 10,0.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.