










А. С. Яценко
Цель работы: исследование тонкой структуры оптического спектра Na.
Электронные оболочки
атомов щелочных металлов Li, Na, K, Rb, Cs, Fr имеют одинаковое строение – вне заполненных оболочек
находится один электрон в состоянии ns. Основным термом является ![]() .
Заполненные оболочки очень прочны, так как их строение такое же, как и у атомов
благородных газов. Внешний s-электрон,
называемый оптическим или валентным, определяет как оптические, так и
химические свойства этих элементов. Эффективное поле, в котором движется этот
электрон, центрально-симметрично, поскольку заполненные оболочки всегда имеют
равный нулю полный орбитальный момент и полный спин. Если в атоме водорода ядро
прямо воздействует на единственный электрон, то в щелочных металлах на s-электрон воздействует не только
ядро, но и электроны, входящие в замкнутые оболочки (табл. 1). Их совокупность
называется атомным остатком. На больших расстояниях эффективное поле остатка
совпадает с кулоновским полем заряда e, так как электроны замкнутых оболочек экранируют поле
ядра. На малых расстояниях (вблизи ядра) экранировка не имеет места, и роль
заполненных оболочек сводится к созданию некоторого постоянного потенциала
.
Заполненные оболочки очень прочны, так как их строение такое же, как и у атомов
благородных газов. Внешний s-электрон,
называемый оптическим или валентным, определяет как оптические, так и
химические свойства этих элементов. Эффективное поле, в котором движется этот
электрон, центрально-симметрично, поскольку заполненные оболочки всегда имеют
равный нулю полный орбитальный момент и полный спин. Если в атоме водорода ядро
прямо воздействует на единственный электрон, то в щелочных металлах на s-электрон воздействует не только
ядро, но и электроны, входящие в замкнутые оболочки (табл. 1). Их совокупность
называется атомным остатком. На больших расстояниях эффективное поле остатка
совпадает с кулоновским полем заряда e, так как электроны замкнутых оболочек экранируют поле
ядра. На малых расстояниях (вблизи ядра) экранировка не имеет места, и роль
заполненных оболочек сводится к созданию некоторого постоянного потенциала ![]() . Однако на всех расстояниях от ядра кривая
. Однако на всех расстояниях от ядра кривая
![]() лежит ниже кулоновского потенциала
лежит ниже кулоновского потенциала ![]() , поэтому уровень
, поэтому уровень ![]() лежит
ниже соответствующего уровня водорода
лежит
ниже соответствующего уровня водорода ![]() где
где 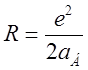 .
.
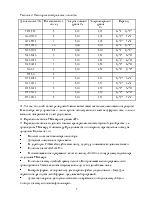
Название элемента |
Символ |
Z |
Электронная конфигурация |
|
Литий Натрий Калий |
|
3 11 19 |
|
Если
положение уровней в атоме ![]() описывается формулой Н.
Бора
описывается формулой Н.
Бора 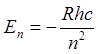 , то в щелочных элементах справедлива
формула Ридберга-Ритца
, то в щелочных элементах справедлива
формула Ридберга-Ритца 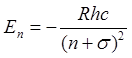 , где
, где 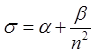 . Величина
. Величина ![]() называется
поправкой Ридберга и превышает по абсолютной величине
называется
поправкой Ридберга и превышает по абсолютной величине ![]() , называемую поправкой Ритца. Эта формула получена Ридбергом эмпирическим
путем. Величина
, называемую поправкой Ритца. Эта формула получена Ридбергом эмпирическим
путем. Величина ![]() носит название «квантового
дефекта».
носит название «квантового
дефекта».
Величина ![]() зависит
от
зависит
от ![]() . При малых
. При малых ![]() электрон
проникает внутрь остатка, что приводит к сильному сдвигу уровней. Существенно
слабее квантовый дефект зависит от
электрон
проникает внутрь остатка, что приводит к сильному сдвигу уровней. Существенно
слабее квантовый дефект зависит от ![]() . Для одного элемента
при росте
. Для одного элемента
при росте ![]() квантовый дефект уменьшается, так как при
этом среднее расстояние между электроном и ядром увеличивается, и поле,
действующее на электрон, все больше приближается к кулоновскому полю
одноэлектронного атома
квантовый дефект уменьшается, так как при
этом среднее расстояние между электроном и ядром увеличивается, и поле,
действующее на электрон, все больше приближается к кулоновскому полю
одноэлектронного атома ![]()
Общая структура спектров определяется
переходами ![]() и т. д. при условии отбора
и т. д. при условии отбора ![]() . Из этих переходов формируются серии,
подобные существующим в спектре водорода. Главная серия возникает при
комбинациях термов
. Из этих переходов формируются серии,
подобные существующим в спектре водорода. Главная серия возникает при
комбинациях термов ![]() и
и ![]() Линии
главной серии наблюдаются как в поглощении, так и в испускании. Первые линии
этой серии являются резонансными. Это означает, что при оптическом возбуждении
атом возвращается в основное состояние, испуская фотон
Линии
главной серии наблюдаются как в поглощении, так и в испускании. Первые линии
этой серии являются резонансными. Это означает, что при оптическом возбуждении
атом возвращается в основное состояние, испуская фотон ![]() той
же частоты
той
же частоты ![]() , что и поглощенный фотон. Когда же
происходит оптическое возбуждение уровня, с которого возможны переходы не
только обратно на основной уровень, но и на другие возбужденные уровни, то
наряду с резонансными наблюдается испускание с частотами, меньшими частоты резонансной
линии.
, что и поглощенный фотон. Когда же
происходит оптическое возбуждение уровня, с которого возможны переходы не
только обратно на основной уровень, но и на другие возбужденные уровни, то
наряду с резонансными наблюдается испускание с частотами, меньшими частоты резонансной
линии.
Потенциалы ионизации и резонансные потенциалы атомов щелочных металлов невелики, порядка 1,5–2 эВ. Поэтому атомы легко возбуждаются даже в сравнительно низкотемпературных источниках. Основные спектральные серии расположены в видимой и инфракрасной области спектра.
Тонкая структура спектров
В атомах щелочных металлов, как и в
атоме водорода, учет спина электрона приводит к появлению тонкой структуры
уровней и спектральных линий. Из-за спин-орбитального взаимодействия имеем ![]() откуда
откуда ![]() В
результате каждый уровень с
В
результате каждый уровень с ![]() расщепится на два
(дублетное расщепление). Для s-уровня
расщепится на два
(дублетное расщепление). Для s-уровня ![]() , и расщепления нет. Структура расщепления
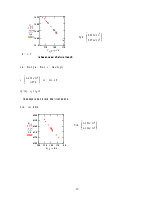
, и расщепления нет. Структура расщепления ![]() уровней представлена на рис. 1.
уровней представлена на рис. 1.
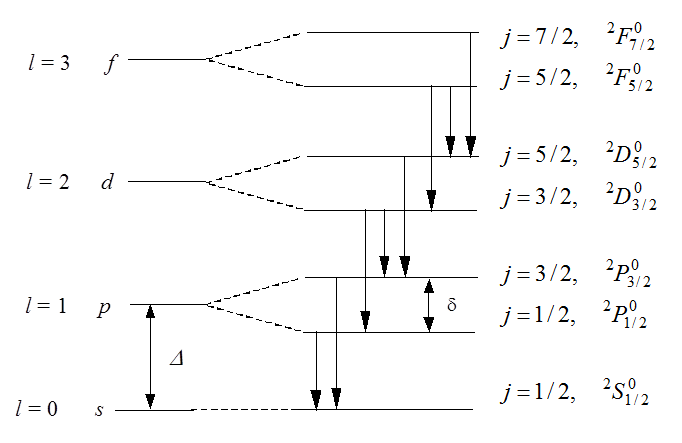
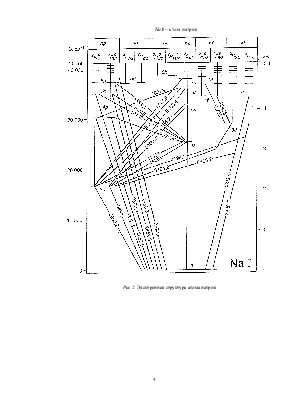
Рис. 1. Дублетное расщепление термов атомов щелочных металлов (масштаб условный, в действительности d << D)
Именно для атомов щелочных металлов
влияние спина проявляется в наиболее отчетливой форме. Это происходит благодаря
тому, что уровни с различными значениями ![]() при
заданном значении
при
заданном значении ![]() отстоят далеко друг от друга.
Так, у
отстоят далеко друг от друга.
Так, у ![]() расстояние между уровнями
расстояние между уровнями ![]() и
и ![]() составляет
2,1 эВ.
составляет
2,1 эВ.
Ширина дублетного расщепления для атома с кулоновским полем
ядра и зарядом ![]() может быть представлена как
может быть представлена как
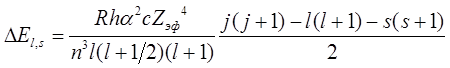 ,
,
где 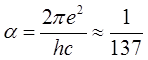 – постоянная тонкой структуры;
– постоянная тонкой структуры; ![]() , где
, где ![]() –
постоянная экранирования.
–
постоянная экранирования.
Ширина дублетного расщепления меняется
от элемента к элементу. Например, для Li величина
тонкого расщепления ![]() составляет 0,34 см-1, а у
составляет 0,34 см-1, а у ![]() – 554,1 см-1. В шкале
частот «практическая» формула для тонкого расщепления имеет вид:
– 554,1 см-1. В шкале
частот «практическая» формула для тонкого расщепления имеет вид:
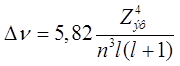 см-1.
см-1.
Спектр атома натрия. Диаграммы Гротриана
На рис. 2 представлена графическая
форма электронной структуры атома натрия в виде диаграмм Гротриана. Основа
построения диаграмм следующая. В общем виде это прямоугольник с заданными
размерами, внутри которого с помощью линий, букв и чисел представлена электронная
структура атомной системы: положение уровней энергий, основные радиационные
переходы, квантовые числа. Каждому известному электронному состоянию на схеме
соответствует своя короткая горизонтальная линия и ряд квантовых чисел, которые
дают значения важных физических параметров. Состояния с одинаковым орбитальным
моментом ![]() возбужденного электрона сгруппированы в колонки –
возбужденного электрона сгруппированы в колонки –
![]() Они образуют последовательность,
сходящуюся к границе ионизации. Такое размещение уровней автоматически
разделяет четные и нечетные состояния. Наклонными линиями с разрывами показаны
радиационные переходы с соответствующими длинами волн в Ангстремах (Å). Они
возникают в результате переходов между уровнями двух соседних колонок,
подчиняясь правилу отбора
Они образуют последовательность,
сходящуюся к границе ионизации. Такое размещение уровней автоматически
разделяет четные и нечетные состояния. Наклонными линиями с разрывами показаны
радиационные переходы с соответствующими длинами волн в Ангстремах (Å). Они
возникают в результате переходов между уровнями двух соседних колонок,
подчиняясь правилу отбора ![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.