





КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
ПОТЕНЦИОМЕТРИЯ
Задача П-3
Измерение температурного коэффициента э. д. с. гальванического элемента и расчет термодинамических величин.
Выполнили:
Еремеева Е.В.
Кондрачук А.И.
группа 343
Новосибирск 2005 г.
Цель лабораторной работы:
Измерение температурного коэффициента э. д. с. гальванического элемента и расчет термодинамических величин.
Теоретическая часть.
Потенциометрия – электрохимический метод исследования и анализа, основанный на определении зависимости между равновесным электродным потенциалом Е и термодинамической активностью (концентрацией) компонентов, участвующих в электрохимической реакции.
Важное применение потенциометрии – определении концентрации и активности ионов водорода, определение констант кислотно-основного равновесия (рН- метрия).
Гальванические элементы.
Электрохимическим ( или гальваническим) элементом называется устройство для получения электрического тока за счет химических реакций. Простейший электрохимический элемент состоит из двух металлических электродов, опущенных в электролит и соединенных между собой металлическим контактом. В гальваническом элементе окислительная и восстановительная части реакции пространственно разделены так, что возникающий электрический ток может быть использован для производства работы. Равновесная э. д. с. элемента, или разность электрических потенциалов двух электродов при отсутствии тока, зависит от константы равновесия реакции, протекающей в элементе, и от активностей реагирующих веществ и продуктов реакции.
Термодинамика гальванических элементов.
Измерения изобарного потенциала для реакций, протекающих в гальванических элементах, можно сразу рассчитать по измеренным равновесным значениям э. д. с. Если э. д. с. гальванического элемента точно уравновешена по отношению к внешнему напряжению, так что не происходит ни зарядка, ни разрядка элемента, и если представить, что через элемент переноситься бесконечно малое количество электричества, то обратимая электрическая работа при постоянных температуре и давлении ( т.е. измерение изобарного потенциала- потенциала Гиббса) будет равна произведению напряжения и количества электричества. Количество электрических зарядов, соответствующее мольным величинам, входящим в уравнение химической реакции, равно zF, где z – число зарядов, которые участвуют в реакции, протекающей в элементе, а F – число Фарадея (96485 Кл/моль). Когда реакция протекает самопроизвольно в соответствии с написанным уравнением, она сопровождается переносом заряда, равного zF. Если количество электричества переноситься при разности потенциалов Е вольт, то производиться работа, равная zFE. Поскольку перенос заряда не сопровождается изменением объема и происходит при постоянной температуре, изменение изобарного потенциала равно
![]() , [1]
, [1]
где Е – разность потенциалов, которая в соответствии с соглашением считается всегда положительной. Для самопроизвольной реакции в элементе величина ΔG отрицательна, а величина Е для этой же реакции, по условию, положительна, поэтому в уравнении [1] появляется знак минус. Электродвижущая сила гальванического элемента не зависит от стехиометрических коэффициентов в уравнении химической реакции, но ΔG зависит от величины z, которая в свою очередь связана с тем, как записано стехиометрическое уравнение реакции.
Изменение энтропии для реакции в гальваническом элементе можно рассчитать по температурному коэффициенту э. д. с., так как
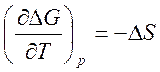 . [2]
. [2]
Подставляя уравнение [1], получаем
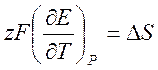 [3].
[3].
Изменение энтальпии в электрохимической реакции можно вычислить, подставляя уравнение [1] и [3] в уравнение
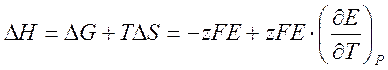 [4].
[4].
Таким образом, измеряя равновесные значения гальванического элемента при ряде температур, можно рассчитать ΔG, ΔS и ΔH для протекающей в элементе реакции.
Уравнение Нернста.
Е = Е о – RT/zF ∙ ln∏ aiυi
Где аi -активности реагирующих веществ и продуктов реакции при заданных условиях.
Стандартная э. д. с. гальванического элемента (Е о) представляет собой э. д. с. такого элемента, в котором активности реагирующих веществ и продуктов реакции равны единице.
Это уравнение часто называется уравнением Нернста. Когда все активности равны единице, член, содержащий логарифм, обращается в нуль, и Е = Е о .
Если активности реагирующих веществ и продуктов реакции соответствуют активностям в равновесной смеси, то уравнение переходит в соотношение
Е о = RT/zF ∙ ℓn K
где К – константа равновесия реакции.
|
Электролиты оказывают большое влияние на ионные коэффициенты активности. Чтобы учесть это влияние, Льюис вместо обычных концентраций ввел ионную силу I которая определяется соотношением
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.