В конические колбы на 100мл отобрали аликвоты 10,00мл, добавили по 25мл 0,6N серной кислоты и титровали 0,2000N раствором перманганата калия. На титрование были затрачены следующие объёмы титранта: 12,55мл, 12,56мл, 12,58мл. Из этих данных рассчитали точную концентрацию приготовленного раствора С2=0,2513моль/л.
Рассчитали необходимые количества реагентов для эксперимента.
|
Пероксид водорода |
Fe2+ |
|
|
Концентрация приготовленного раствора |
1,0538моль/л |
0,2513моль/л |
|
Приблизительная концентрация в реакторе |
0,250моль/л |
0,0125моль/л |
|
Необходимый объём рабочего раствора |
11,86мл≈12,00мл |
2,487мл≈2,50мл |
|
Концентрация в эксперименте |
0.2529моль/л |
0,01257моль/л |
Максимально возможное количество кислорода, выделяющегося в реакции, рассчитывается по формуле (7) для каждого значения температуры.
Опыты проводили при комнатной температуре в 294K, и атмосферном давлении – 764,6торр.
1). Температура 298,2К;
2). Температура 308,2К.
3). Температура 318,2К.
|
Номер опыта |
T опыта, K |
Макс. объём кислорода, мл |
Время, сек |
Время, мин |
Объём кислорода, мл |
Разность предельного и текущего объёма, мл |
|
|
1 |
298,2 |
312 |
26,0 |
0,433 |
5 |
307 |
0,0162 |
|
55,4 |
0,923 |
10 |
302 |
0,0326 |
|||
|
88,7 |
1,478 |
15 |
297 |
0,0493 |
|||
|
123,2 |
2,053 |
20 |
292 |
0,0663 |
|||
|
155,8 |
2,597 |
25 |
287 |
0,0836 |
|||
|
193,0 |
3,217 |
30 |
282 |
0,1012 |
|||
|
231,0 |
3,850 |
35 |
277 |
0,1191 |
|||
|
2 |
308,2 |
322 |
11,5 |
0,192 |
5 |
317 |
0,0156 |
|
22,0 |
0,367 |
10 |
312 |
0,0315 |
|||
|
34,0 |
0,567 |
15 |
307 |
0,0477 |
|||
|
46,6 |
0,777 |
20 |
302 |
0,0641 |
|||
|
58,4 |
0,973 |
25 |
297 |
0,0808 |
|||
|
69,4 |
1,157 |
30 |
292 |
0,0978 |
|||
|
80,4 |
1,340 |
35 |
287 |
0,1150 |
|||
|
93,8 |
1,563 |
40 |
282 |
0,1326 |
|||
|
3 |
318,2 |
333 |
5,3 |
0,088 |
5 |
328 |
0,0151 |
|
10,4 |
0,173 |
10 |
323 |
0,0305 |
|||
|
15,6 |
0,260 |
15 |
318 |
0,0462 |
|||
|
20,8 |
0,347 |
20 |
313 |
0,0620 |
|||
|
25,9 |
0,432 |
25 |
308 |
0,0781 |
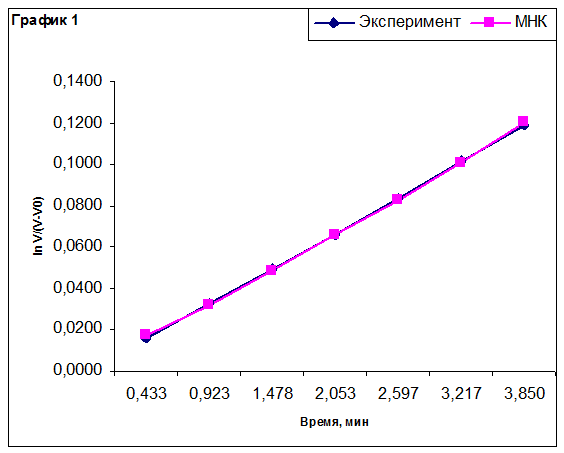
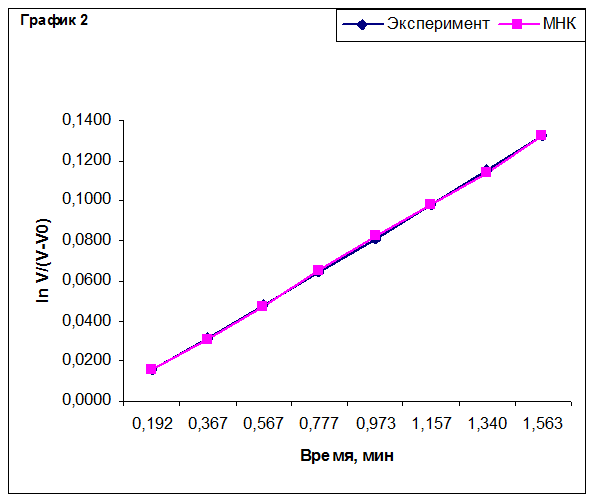
Построение графиков для определения эффективной константы скорости реакции.
|
|
|
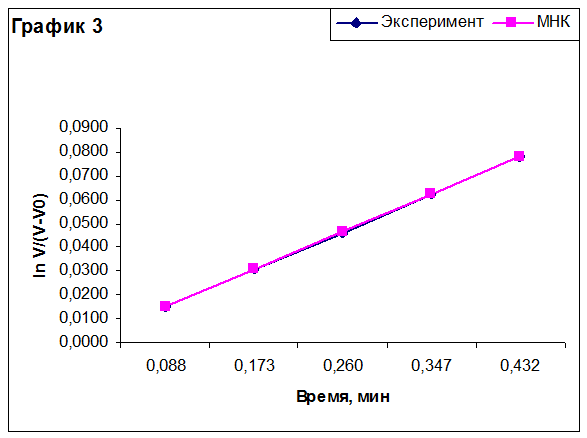
По методу наименьших квадратов для каждого эксперимента была рассчитана эффективная константа скорости реакции. Из полученных значений рассчитали величины предэкспоненциального множителя k0 и энергии активации реакции Ea. Результаты приведены в таблице.
|
Температура, K |
298,2 |
308,2 |
318,2 |
|
Эффективная константа скорости, мин-1 |
0,030±0,001 |
0,085±0,002 |
0,183±0.002 |
|
Множитель k0, мин-1 |
(4,1±0,2)*1011 |
(9,2±0,4)*1010 |
(2,00±0,07)*1010 |
|
Энергия активации, Ea, кДж/моль |
80±3 |
71±3 |
63±2 |
Эффективная константа скорости имеет размерность константы скорости реакции первого порядка в силу уравнения (2). Относительная ошибка энергии активации составляет 3-4%, относительная ошибка предэкспоненциального множителя – 3,5-5%.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.