Новосибирский Государственный Университет
факультет Естественных Наук
Лабораторная работа по химической кинетике на тему:
ГОМОГЕННЫЙ КАТАЛИЗ ДИСПРОПОРЦИОНИРОВАНИЯ H2O2 АКВА-ИОНАМИ Fe2+
Выполнили:
Кутузов М.М.
Миньков В.С.
Руководитель:
123
Новосибирск
2006
Цель работы: Определить порядок реакции диспропорционирования перекиси водорода по [H2O2].
Теоретический обзор: Разложение перекиси водорода на воду и молекулярный кислород является характерным свойством этого соединения:
2H2O2![]() 2H2O+O2 (1)
2H2O+O2 (1)
Реакция (1) ускоряется под действием излучений, например, ультрафиолетового света, а так же в присутствии гетерогенных и гомогенных катализаторов.
Диспропорционирование перекиси водорода в системе «аква-ионы Fe2+-H2O2», включает в общем случае следующие стадии:
1.
Fe2++H2O2![]() Fe3++O*H+OH-;
Fe3++O*H+OH-;
2.
Fe2++O*H![]() Fe3++ OH-;
Fe3++ OH-;
3.
O*H+H2O2![]() HO*2+H2O;
HO*2+H2O;
4.
Fe3++HO*2![]() Fe2++O2+H+;
Fe2++O2+H+;
5.
Fe3++O*2-![]() Fe2++O2;
Fe2++O2;
6.
Fe2++ HO*2![]() Fe3++HO2-.
Fe3++HO2-.
Особенностью данного типа механизма является невозможность выделить стадии продолжения цепи, а ответственные за разложение перекиси водорода активные частицы – ионы Fe2+, Fe3+ и радикалы O*H, HO*2 (O*2-) образуются и расходуются в результате циклического процесса. При этом вся совокупность стадий реализуется только при условии 0,5<[H2O2]/[Fe2+]<200; при 200<[ H2O2]/[Fe2+]<104 стадия 2 не протекает, а в случае 0,5>[H2O2]/[Fe2+] схема механизма включает только реакции 1 и 2, отражающие процесс стехиометрического окисления Fe2+в Fe3+, при этом Диспропорционирование H2O2 не протекает. Поскольку в ходе процесса каталитического диспропорционирования H2O2 по брутто-реакции выделяется молекулярный кислород, средством слежения за кинетикой реакции выбран волюмометрический метод. При применении данного метода было установлено, что скорость газовыделения W20 в системе Fe2+-H2O2 растет прямо пропорцианально концентрациям Fe2+ и H2O2. Показано также, что W20 растет с увеличением pH раствора, что связывают с конкуренцией стадий 4 и 5. Однако следует иметь в виду, что с ростом pH раствора интенсивно начинают протекать процессы гидролиза ионов Fe3+; при этом при pH>3.5 можно наблюдать переход от гомогенного течения реакции к гетерогенному с участием слаборастворимых основных солей Fe3+ и, как следствие, уменьшение скорости реакции.
Экспериментальная часть:
Для работы приготовили растворы:
Раствор №1. 200мл 0,95М раствора H2O2;
Раствор №2. 500мл 0,2N раствора H2SO4;
Раствор №3. 100мл 0,25М раствора аква-комплекса Fe2+.
Условия опытов:
|
№ |
Т, |
H2O2 |
Fe2+ |
H2SO4 |
|||
|
Конц., М |
V,мл |
Конц., М |
V,мл |
Конц., М |
V,мл |
||
|
1 |
25 |
0,125 |
6,579 |
0,0125 |
2.5 |
0.01 |
5 |
|
2 |
25 |
0,250 |
13,158 |
0.0125 |
2.5 |
0.01 |
5 |
|
3 |
25 |
0,500 |
26,316 |
0.0125 |
2.5 |
0.01 |
5 |
Для расчета будем считать, что реакция
H2O2
![]() H2O+0.5O2
H2O+0.5O2
Имеет первый порядок по [H2O2], тогда 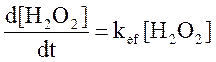 , где
, где ![]() - эффективная константа скорости.
- эффективная константа скорости. 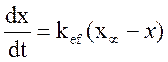 , где x- число
молей O2,
, где x- число
молей O2, ![]() - число
молей O2, которое можно получить при полном
разложении H2O2.
Так как при фиксированных температуре и давлении x пропорцианально объему, то:
- число
молей O2, которое можно получить при полном
разложении H2O2.
Так как при фиксированных температуре и давлении x пропорцианально объему, то:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.