L = 0 1 2 3 4 5 6
S P D F G H I
Слева вверху
от этого символа указывается число ![]() , называемое мультиплетностью
терма, а справа внизу — значение полного момента. Так
, называемое мультиплетностью
терма, а справа внизу — значение полного момента. Так ![]() —
означает уровни с
—
означает уровни с ![]()
![]() и
и ![]()
![]() .
.
Еще раз подчеркнем, что рассмотренная методика построения электронных конфигураций атома основана на нулевом приближении решения уравнения Шредингера (1), учитывает наличие спина у электрона и принцип Паули.
Эффективность данного подхода, а также его ограниченность будут рассмотрены ниже (в разделе), а также при анализе последовательности заполнения электронных оболочек, т.е. формировании периодической системы (Д.И.Менделеева).
1.1. Энергетические уровни атомов с одним
электроном в верхней оболочке
Атом водорода
является единственной системой, для которой уравнение Шредингера может быть
решено точно. Уровни энергии атома водорода и сходных с ним ионов ![]()
![]() , содержащих всего по
одному электрону, определяются формулой Бора:
, содержащих всего по
одному электрону, определяются формулой Бора:
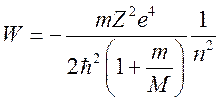 ,
(7)
,
(7)
где Ze,
M - заряд и масса ядра. Энергетические уровни ![]() раз
вырождены.
раз
вырождены.
В атомах щелочных металлов и в сходных с ними ионах один электрон движется вокруг атомного остова с полностью заполненными внутренними электронными оболочками, для которых выполняются условия L = 0 и S = 0, т.е. данный остов должен обладать сферической симметрией. Естественно предположить, что заряд электронов остова частично компенсирует заряд ядра и потенциальная энергия взаимодействия в (2) может быть записана в виде [2,3]:
![]()
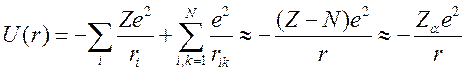 , (8)
, (8)
где ![]() —
эффективный заряд иона остова.
—
эффективный заряд иона остова.
Внешний электрон, взаимодействуя с остовом, может обусловить его поляризацию. Разлагая поле остова по моментам и учитывая только дипольную составляющую для потенциальной энергии, получим:
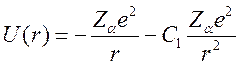 ,
(9)
,
(9)
где ![]() —
постоянная, характеризующая величину дипольного момента.
—
постоянная, характеризующая величину дипольного момента.
При таком потенциале угловые функции уравнения Шредингера остаются теми же, что и в случае атома водорода, а радиальная часть уравнения имеет вид:
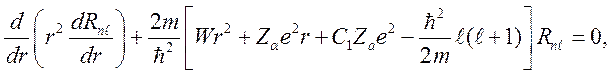 (10)
(10)
который совпадает с уравнением для водорода, если положить
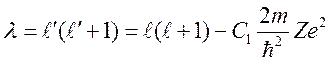 ,
,
где ![]() —
величина равная:
—
величина равная:
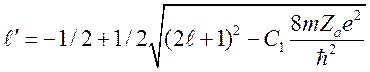 . (11)
. (11)
Предполагая ![]() малой, получим
малой, получим
![]()
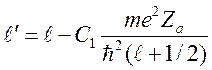 .
(12)
.
(12)
Таким образом, уравнение Шредингера для радиальных функций сведено к виду, для которого хорошо известно решение для энергии:
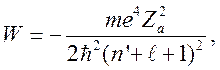 (13)
(13)
где вместо главного квантового
числа ![]() необходимо поставить
необходимо поставить ![]() или
или
![]()
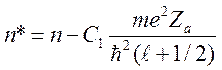 . (14)
. (14)
Следовательно, энергия уровней равна:
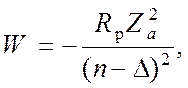 (15)
(15)
где ![]()
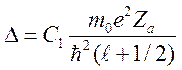 зависит от
зависит от ![]() ,
, 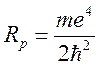 .
.
Как видно из
(15), энергетические состояния с малым ![]() возмущаются
сильнее, а с ростом
возмущаются
сильнее, а с ростом ![]() квантовый дефект
квантовый дефект ![]() стремится к нулю, и энергетические состояния
близки к водородным.
стремится к нулю, и энергетические состояния
близки к водородным.
Таким образом,
учет электростатического взаимодействия электрона с полем внутренних
электронов, проведенный нами в виде возмущения дипольного типа, приводит
к снятию вырождения по ![]() . Состояние с заданным n
распадается на n состояний, соответствующих различным значениям
. Состояние с заданным n
распадается на n состояний, соответствующих различным значениям ![]() . Кроме этого, как будет показано в разделе
1.3, все термы расщепляются на два за счет спин-орбитального взаимодействия.
. Кроме этого, как будет показано в разделе
1.3, все термы расщепляются на два за счет спин-орбитального взаимодействия.
На рис.1, в
качестве примера, приведена схема энергетических уровней натрия. Для сравнения
там же приведены энергетические уровни водорода. Приведенная схема наглядно
иллюстрирует зависимость энергии атома натрия от главного квантового числа n
и орбитального ![]() электрона в верхней оболочке.
Энергии связи электрона в атоме водорода равны:
электрона в верхней оболочке.
Энергии связи электрона в атоме водорода равны: ![]() и
и ![]() . Тогда как в Na энергии связи 3S
электрона
. Тогда как в Na энергии связи 3S
электрона ![]() и
и ![]() и
только у 3d электрона
и
только у 3d электрона ![]() , т.е. близка к уровню
энергии атома водорода в состоянии с n = 3. Из приведенных
данных видно, что изменение энергии за счет
, т.е. близка к уровню
энергии атома водорода в состоянии с n = 3. Из приведенных
данных видно, что изменение энергии за счет ![]() при n = 3
в атоме Na больше, чем изменение энергии за счет роста n (c n = 2
до n = 3) в атоме водорода.
при n = 3
в атоме Na больше, чем изменение энергии за счет роста n (c n = 2
до n = 3) в атоме водорода.
С увеличением
атомного веса щелочного металла возрастает главное квантовое число n и
величина дефекта ![]() наиболее глубокого S-терма
(см. таблицу 1).
наиболее глубокого S-терма
(см. таблицу 1).
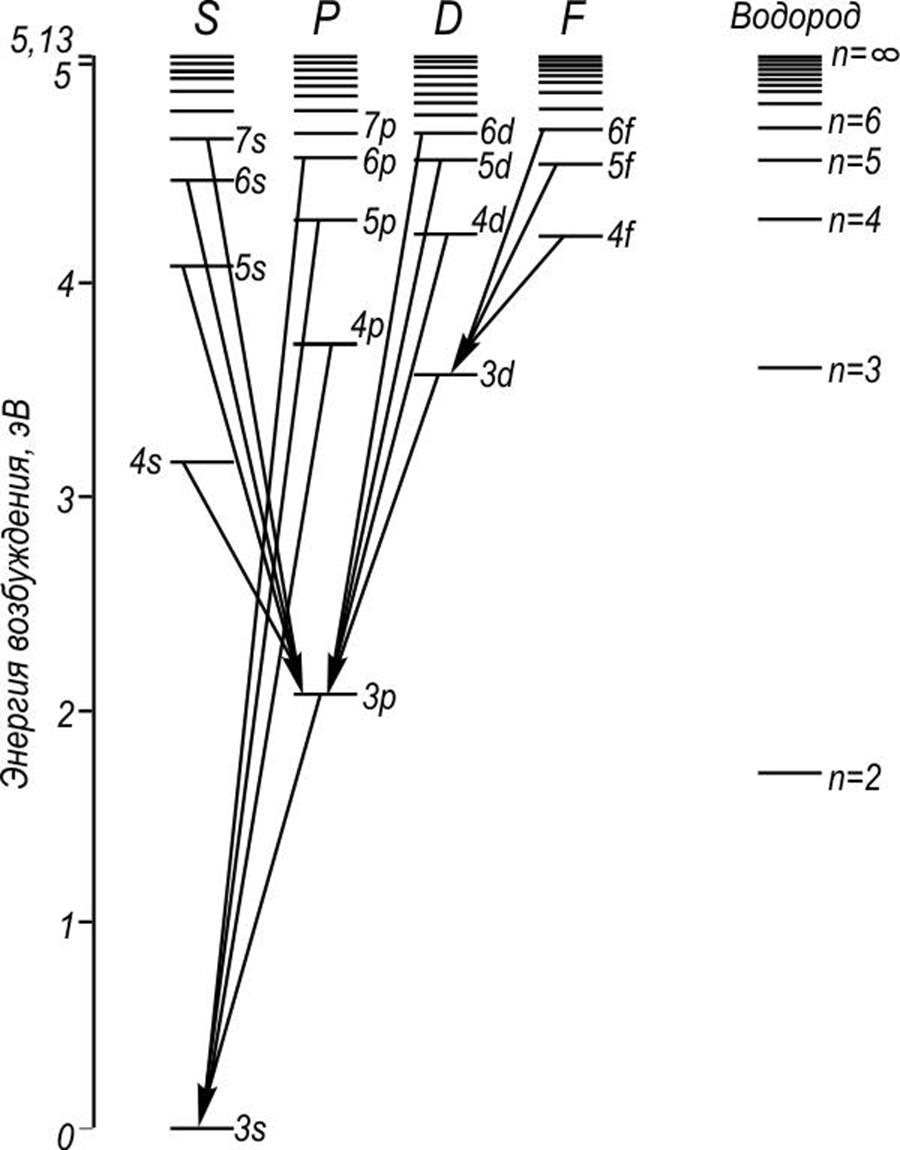

Таблица 1
|
Элемент |
n |
|
|
Li |
2 |
0,41 |
|
Na |
3 |
1,37 |
|
K |
4 |
2,23 |
|
Rb |
5 |
3,20 |
|
Gs |
6 |
4,13 |
Для данного
элемента и данного ![]() квантовый
дефект
квантовый
дефект ![]() практически не зависит от n, в полном соответствии с (14).
практически не зависит от n, в полном соответствии с (14).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.