



1. Понятие о круговых процессах (циклах), термический КПД.
II закон термодинамики.
2. Перенос тепла теплопроводностью. Температурный градиент.
Закон Фурье.
1. Понятие о круговых процессах (циклах), термический КПД.
II закон термодинамики.
Замкнутый термодинамический процесс называется циклом. Все тепловые машины работают по тепловым циклам. На рис 1 изображен произвольный политропный (т. е. состоящий из политропных процессов) тепловой цикл 1-А-2-В-1.
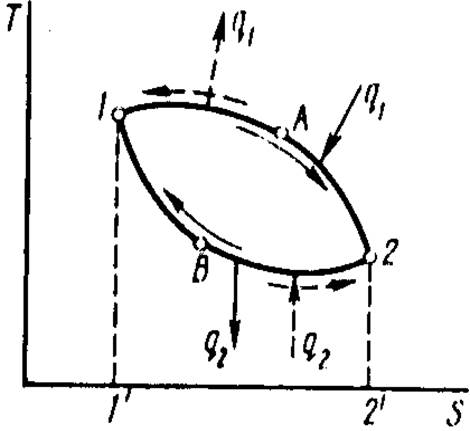
Рис 1. Прямой и обратный произвольные политропные циклы.
В соответствии с вторым законом термодинамики для превращения тепловой энергии в любой другой вид энергии необходимо иметь как минимум два источника теплоты: горячий с температурой Т1 и холодный с температурой Т2. При этом из подводимой от горячего источника к РТ теплоты q1 часть q2 должна быть отдана холодному источнику. Тогда, в работу превратится
wц = q1 – q2.
wц называется
полезной теплотой. Поскольку в круговом процессе рабочее тело возвращается в
первоначальное состояние, то ![]() .
.
1-А-2-В-1 — прямой цикл. В прямых циклах теплота превращается в работу, это циклы двигателей.
Если же совершается цикл против часовой стрелки 1-В-2-А-1, его называют обратным циклом, В обратных циклах за счет затраты энергии w теплота q2 передается от холодного источника горячему, в результате чего происходят охлаждение холодного источника и нагрев горячего (при их конечных размерах) и трансформация теплоты с низкого температурного уровня Т2 на высокий T1. Обратные циклы осуществляются в холодильных установках.
Цикл, осуществляемый с целью охлаждения, называется холодильным, а с целью нагрева — теплонасосным.
Для оценки работы непрерывно действующей машины важно знать долю теплоты от q1, превращенную в полезную энергию. В идеальных тепловых машинах, в которых отсутствуют потери на трение, излучение, утечки рабочего тела через неплотности и другие потери, степень совершенства цикла принято оценивать термическим коэффициентом полезного действия (КПД).
Термический коэффициент полезного действия (к. п. д.) — отношение количества полученной работы w к количеству затраченной теплоты:
ηt = w / q1 = ( q1 – q2) / q1 = 1 – (q2 / q1).
Чем больше ηt , тем более совершенной будет тепловая установка, ибо в ней из всей сообщенной рабочему телу теплоты от горячего источника превращается в механическую энергию максимально возможная доля теплоты от q1. Этого можно достичь лишь путем наиболее целесообразного подбора тех процессов, из которых образуется цикл. Поэтому понятие о термическом КПД связано с сущностью второго закона термодинамики.
Второй закон термодинамики устанавливает, возможен или невозможен тот или иной процесс, в каком преимущественном направлении будет он протекать, когда система достигнет термодинамического равновесия, и при каких условиях от системы можно получить максимальную работу.
Применительно к тепловым явлениям второй закон термодинамики устанавливает весьма важную специфическую особенность превращения теплоты в работу в тепловых двигателях.
Второй закон термодинамики является опытным законом, основывающимся на многовековых наблюдениях ученых. Однако установлен он был только в середине XIX в. В неявной форме этот закон содержался уже в труде С. Карно, где указывалось на то, что непрерывно действующая тепловая машина должна работать по определенному циклу и иметь по крайней мере два источника теплоты: один — горячий с температурой Т1 а другой — холодный с температурой Т2 (Т1 > Т2), и поэтому в ней невозможно целиком перевести в работу всю теплоту q1, подведенную к рабочему телу. Часть этой теплоты в виде q2 неминуемо должна быть отдана холодному источнику, и только разность между этими количествами теплоты превращается в механическую энергию.
Это утверждение, высказанное впервые в 1824 г. французским инженером и ученым Сади Карно, составляет сущность второго закона термодинамики. Согласно ему, «Повсюду, где имеется разность температуры, может происходить возникновение движущей силы. Движущая сила тепла не зависит от агентов, взятых для ее развития: ее количество исключительно определяется температурой тел, между которыми в конечном счете производится перенос тепла. Температура газа должна быть первоначально как можно выше, чтобы получить значительное развитие движущей силы. По той же причине охлаждение должно быть как можно больше. Нельзя надеяться хотя бы когда-либо практически использовать всю движущую силу топлива».
Эти положения Карно устанавливают условия, при которых (в тепловых двигателях) возможно превращение теплоты в работу, показывают, от чего собственно зависит эффективность этого превращения.
Затем он разрабатывался многими, но наиболее успешно Р. Клаузиусом и В. Томсоном (Кельвином). Немецкий физик Р. Клаузиус в 1850 г. сформулировал второй закон термодинамики следующим образом: «Теплота не может переходить сама по себе от одного тела к другому, имеющему температуру более высокую, чем первое тело; для обратного перехода надо затратить работу».
В. Томсон в 1851 г. указывал на то, что «невозможно превратить в периодически действующем двигателе в работу теплоту какого-либо тела, не производя никакого другого действия, кроме охлаждения тела».
Процессы, которые протекают самостоятельно, называют самопроизвольными.
В природе существует большое количество таких процессов, которые в одном направлении протекают легко — «сами по себе», не требуя никаких дополнительных процессов (например, переход теплоты от горячего тела к холодному), а в обратном направлении не могут осуществляться самостоятельно (например, переход теплоты от холодного тела к горячему в холодильных установках возможен только при дополнительном процессе совершения механической работы).
Самопроизвольные процессы — диффузия, переход теплоты от тела, более нагретого, к телу, менее нагретому, при конечной разности температур, процессы растворения являются необратимыми. Согласно этому в общем виде второй закон термодинамики формулируют так: любой реальный самопроизвольный процесс является необратимым.
Статистическое толкование закона, доказавшее ограниченность его действия, было осуществлено Л. Больцманом в 1870-1876 гг. Согласно ему: «Все естественные процессы являются переходом от менее вероятных к более вероятным состояниям». Формулировка Л. Больцмана самая широкая и содержательная, с ее помощью путем логических рассуждений можно получить все остальные и ясно указать пределы применимости второго закона. Эта формулировка естественно вводит понятие энтропии, сразу же связывая его с термодинамической вероятностью состояния системы, т. е. давая ему статистическое толкование.
Общее выражение второго закона для
обратимых и необратимых процессов имеет вид:  ,
,
где dQ – подводимая к телу теплота; Т – температура; dS – энтропия.
Энтропия изолированных систем при обратимых процессах постоянна, а при необратимых возрастает, уменьшаться она не может. Поскольку все реальные процессы необратимы, то второй закон называют законом возрастания энтропии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.