11. Количество образующегося карбоната кальция, моль/дм3
|
[CaCO3] = [C)2]sum i - [C)2]sum f + DNa2CO3 |
(21) |
12. Уравнение электронейтральности раствора, моль/дм3
|
|
(22) |
Количество уравнений совпадает с числом неизвестных переменных концентраций. Однако в некоторых уравнениях используются объёмные концентрации частиц (моль/дм3), а в других - активности. Для приведения величин к единицам объёмной концентрации необходимо учесть коэффициенты активности (f1, f2, f3) соответственно 1-, 2- и 3-х зарядных ионов. Коэффициенты определяются из ионной силы раствора по уравнению Дебая-Хюккеля [6]. Поскольку коэффициенты активности меняются при обработке растворов, но не могут быть заранее предсказаны, методика расчёта включает предварительный расчёт с использованием исходных коэффициентов, затем определение ионной силы обработанного раствора и вычисление новых коэффициентов активности. Такой пересчёт проводится несколько раз, пока разница между значениями коэффициентов, полученными при двух последовательных приближениях по циклу расчёта, не станет малой величиной (менее 0,01).
Возможность расчётов при различных температурах заложено в используемых константах, которые выражены как температурные функции.
Если выразить все неизвестные переменные концентрации через концентрацию протона, система уравнений (11-22) приводит к очень громоздкому уравнению четвёртого порядка по [H+] (23), аналитическое решение которого не представляется возможным.
|
|
(23) |
где выражения Ф1 и Ф2 равны (24). Выражения S1 и S2 для SiO2 аналогичны Ф1 и Ф2.
|
|
(24) |
Решение системы уравнений было выполнено численным методом на ЭВМ подстановкой значений рН. При этом однозначно определяются все неизвестные переменные и доза извести.
Решение системы уравнений проводилось с учетом дополнительных условий - расчёт до момента начала образования осадка CaCO3 или осадка Mg(OH)2 и после - путём сравнения расчётных величин:
|
|
(25) |
|
|
(26) |
где [CO2]sum расч рассчитывается в предположении образования осадка CaCO3 по ПРкк.
В качестве примера приводится расчёт известкования воды состава [Ca2+]=72; [Mg2+]=14,5; [Na++K+]=20,3; [HCO3-]=140,3; [SO42-]=140; [Cl-]=15; [SiO32-]=3; [Fe2O3+Al2O3]=0,6; взв. вещества=10 (все в мг/кг). (р. Волга, г. Казань, температура обработки 303К). Результаты представлены на рис. 1 и 2.
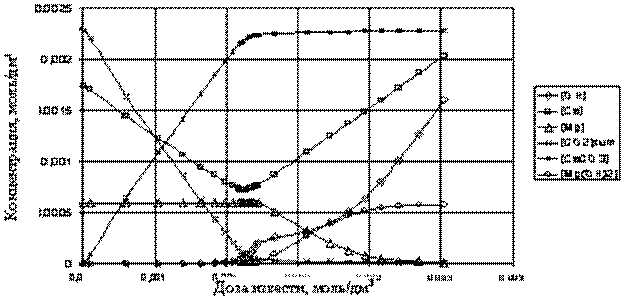
Рис. 1. Зависимость состава обработанной воды и количества осадков от дозы
извести.

Рис. 2. Зависимость показателей обработанной воды от дозы извести.
Из рисунков видно, что выпадение карбоната кальция происходит практически сразу при добавлении извести, что указывает на то, что волжская вода находится в состоянии насыщения по CaCO3. Образование осадка гидроксида магния начинается при значительном избытке извести или свободной ОН- (рН=10,1). pH исходной воды 7,8-7,9. Эти данные находятся в полном соответствии с известными экспериментальными фактами. Кривые Жо - доза извести, Що - доза извести и солесодержание - доза извести носят экстремальный характер. Интересно отметить, что минимумы на кривых Жо, Що и солесодержание - доза извести не совпадают и находятся в диапазоне расчётного избытка извести 0,06-0,15 мг-экв/кг, что указывает на возможный путь оптимизации процесса.
В данной модели не учитывается кинетический контроль некоторых протекающих реакций, например, образования осадков, а также не рассматривается вероятность образования осадков другого состава, таких как карбонаты железа и магния и смешанный карбонат кальция-магния.
Модель описывает термодинамически стабильную систему, пришедшую к равновесию, и может быть полезна для представления общего хода процесса. С использованием математической модели разработан программный комплекс, основанный на использовании Visual Basic и Microsoft Excel, и реализуемый на компьютерах класса Pentium или других, использующих операционные системы Windows-95/98/2000/Me/XP.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.