






















































МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ
ФЕДЕРАЦИИ
Московский энергетический институт
(технический университет)
Волжский филиал
Учебное пособие
Волжский 2001
УДК
ББК
Рецензенты:
Прибылова И.А., Синебабнова Н. В.
Водно-химические режимы ТЭС и их расчёт. Учебное пособие
Изложены теоретические основы поведения растворённых в водном теплоносителе примесей (газов и электролитов), изменение их характеристик с ростом параметров теплоносителя. Рассмотрено влияние коррекционной обработки питательной и котловой воды на состав и структуру отложений в конденсатно-питательном тракте, паровых котлах и проточной части турбин. Обобщены методические рекомендации по применению и организации рациональных водно-химических режимов тепловых электростанций с прямоточными и барабанными котлами. Приводятся подробные расчёты типовых задач с обсуждением или оценкой результатов расчёта.
Для студентов специальности 100600 и других, близких по профилю специальностей энергетических вузов. Может быть использовано студентами при выполнении научно-исследовательских работ, курсового и дипломного проектирования.
УДК
ББК
Введение
С увеличением единичной мощности котлов и ростом параметром рабочей среды организация водно-химического режима приобретает особое значение в обеспечении надёжной работы ТЭС без повреждений и снижения экономичности, вызванных коррозией внутренних поверхностей теплоэнергетического оборудования, а также образованием накипи и отложений на теплопередающих поверхностях, отложений в проточной части турбин, шлама в оборудовании и трубопроводах.
При решении этих задач учитываются параметры работы оборудования, допустимая степень загрязнения теплоносителя по тракту энергоблока, показатели обуславливающие интенсивность коррозионного процесса конструктивных материалов, а также условия подготовки добавочной воды, обработки конденсата и питательной воды.
Учебная и научно-исследовательская литература, могущая служить пособием для студентов, обучающихся по специальности «Технология воды и топлива на ТЭС», крайне ограничена или просто отсутствует. С учётом этого было написано учебное пособие по курсу «Водно-химические режимы теплоэнергетических установок», которое охватывает ряд ключевых разделов данного фундаментального курса.
1. Система СО2 –Н2О
При растворении в чистой воде (конденсате), в результате присосов СО2 из воздуха, образуется ещё один слабый электролит – угольная кислота, которая крайне отрицательно влияет на металл оборудования, интенсифицируя общую коррозию:
СО2(г)
+ Н2О ![]() СО2(р)
(1-1)
СО2(р)
(1-1)
СО2
+ Н2О![]() Н2СО3
(1-1а)
Н2СО3
(1-1а)
Н2СО3
![]() Н+ + НСО3-
(1-1б)
Н+ + НСО3-
(1-1б)
НСО3-
![]() Н+ + СО32-
(1-1в)
Н+ + СО32-
(1-1в)
СО2
+ Н2О ![]() Н+ + НСО3-
(1-1г)
Н+ + НСО3-
(1-1г)
![]() Коррозия
конденсатно-питательного тракта опасна не только тем, что при этом питательная
вода обогащается продуктами коррозии. С увеличением их выноса в парогенератор
усиливаются процессы подшламовой коррозии и железооксидного накипеобразования.
Эти процессы со временем могут привести к повреждениям, требующим аварийной
остановки парогенератора.
Коррозия
конденсатно-питательного тракта опасна не только тем, что при этом питательная
вода обогащается продуктами коррозии. С увеличением их выноса в парогенератор
усиливаются процессы подшламовой коррозии и железооксидного накипеобразования.
Эти процессы со временем могут привести к повреждениям, требующим аварийной
остановки парогенератора.
Реакция (1-1а) сильно сдвинута влево. Из общего
количества СО2 , присутствующей в воде, лишь около 0,2 % находится в
виде Н2СО3. Поэтому в дальнейшем под С![]() будем понимать сумму молярных концентраций
будем понимать сумму молярных концентраций ![]() =
= ![]() +
+ ![]() (исключая ионы НСО3- и
СО32-). Равновесие реакций характеризуется константами:
(исключая ионы НСО3- и
СО32-). Равновесие реакций характеризуется константами:
![]() =
=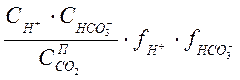 ; (1-2а)
; (1-2а)
![]() =
=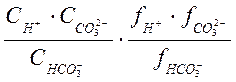 ; (1-2б)
; (1-2б)
![]()
![]() =
= 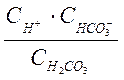 . (1-2в)
. (1-2в)
Константу диссоциации, отвечающую реакции (1-1б),
рассматривают как истинную. В практических расчётах используется, как правило,
константа диссоциации угольной кислоты по первой ступени![]() ,
отвечающая уравнению (1-1г). Температурная зависимость отрицательного логарифма
константы
,
отвечающая уравнению (1-1г). Температурная зависимость отрицательного логарифма
константы ![]() в небольшом интервале температур
выражается уравнением :
в небольшом интервале температур
выражается уравнением :
![]() =
=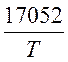 +
+![]()
![]() -
- ![]() -
- ![]() (1-3)
(1-3)
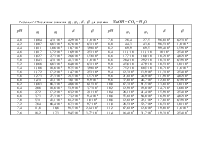
В таблице 1.1 приведены значения констант диссоциации углекислоты в водном растворе.
|
Т, К |
|
|
|
Т, К |
|
|
|
|
273 278 283 288 291 293 298 303 313 |
2,5 1,56 1,72 1,75 1,75 1,75 1,72 1,70 1,62 |
2,65 3,04 3,43 3,8 4,0 4,15 4,31 4,71 5,06 |
2,36 2,77 3,24 3,71 4,0 4,2 4,69 5,13 6,03 |
323 333 343 353 373 395 423 438 473 |
1,52 1,52 1,52 1,52 1,52 1,52 1,52 1,52 1,52 |
5,16 5,02 4,69 4,21 5,72 4,80 3,62 2,90 1,26 |
6,73 7,20 7,52 7,55 11,1 9,15 7,25 6,30 4,90 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.