

















Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Рыбинская государственная авиационная технологическая
академия им. П.А. Соловьева
КАФЕДРА ОБЩЕЙ И ТЕХНИЧЕСКОЙ ФИЗИКИ
на заседании методического
семинара кафедры физики
« » _________ 2005 г.
Зав.каф. Пиралишвили Ш.А.
ЛАБОРАТОРНАЯ РАБОТА № КФ – 2
Изучение спектральных
закономерностей атома водорода
|
Нормоконтролёр: |
Автор: к. ф–м. н., доцент Шалагина Е.В. |
|
. |
|
|
____________ |
___________________ |
|
Рецензент: к. ф–м. н., доцент Шувалов В.В. |
|
|
___________________ |
ИНСТРУКЦИЯ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
Работа выполняется в соответствии с общими требованиями техники безопасности, действующими в учебных лабораториях кафедры физики.
ЦЕЛЬ РАБОТЫ:
1. Знакомство с элементами квантово-механической теории строения атома водорода на примере изучения его спектральных закономерностей.
2. Экспериментальное
определение длин волн ![]() спектральных линий серии
Бальмера в видимой части спектра при помощи монохроматора УМ-2 (визуальный
метод наблюдения спектра).
спектральных линий серии
Бальмера в видимой части спектра при помощи монохроматора УМ-2 (визуальный
метод наблюдения спектра).
3. Расчет
по найденным на эксперименте значениям длин волн ![]() для
серии Бальмера постоянной Ридберга и массы электрона.
для
серии Бальмера постоянной Ридберга и массы электрона.
ПРИБОРЫ И ОБОРУДОВАНИЕ: универсальный монохроматор УМ-2, водородная газоразрядная трубка, высоковольтный источник питания водородной трубки.
1 ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Излучение не взаимодействующих друг с другом атомов состоит из отдельных спектральных линий. В соответствии с этим спектр испускания атомов называется линейчатым. Было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы, называемые сериями. Длины волн (частоты) каждой серии описываются определенной закономерностью (формулой). Спектр атома водорода выделяется своей простотой, что объясняется простотой структуры этого атома, состоящего из ядра и одного электрона, движущегося в поле точечного заряда. Спектр атома водорода состоит из нескольких серий: серии Лаймана (в ультрафиолетовой части спектра), серии Бальмера (видимая и близкая ультрафиолетовая область) и серий Пашена, Брэкета, Пфунда и др., лежащих в инфракрасной области спектра. На рисунке 1.1 представлена часть спектра атомного водорода в видимой и близкой ультрафиолетовой области (серия Бальмера).
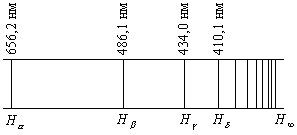
Рисунок 1.1 – Схема линий серии Бальмера
Символами ![]() обозначены соответственно красная,
голубая и две фиолетовые линии, находящиеся в видимой области спектра,
обозначены соответственно красная,
голубая и две фиолетовые линии, находящиеся в видимой области спектра, ![]() указывает границу серии Бальмера,
лежащую в ультрафиолетовой области. Расстояние между линиями закономерно
убывает по мере перехода от более длинных волн к коротким.
указывает границу серии Бальмера,
лежащую в ультрафиолетовой области. Расстояние между линиями закономерно
убывает по мере перехода от более длинных волн к коротким.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.