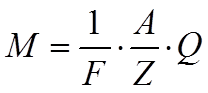 где С – коэффициент пропорциональности,
одинаковый для всех химических элементов. Обычно вместо коэффициента С
вводят величину ему обратную C = 1 / F . Тогда второй закон Фарадея имеет вид
где С – коэффициент пропорциональности,
одинаковый для всех химических элементов. Обычно вместо коэффициента С
вводят величину ему обратную C = 1 / F . Тогда второй закон Фарадея имеет вид
Из этой формулы становится понятным и смысл числа Фара-дея: число Фарадея F численно равно количеству элект-ричества Q , при прохождении которого через электролит, на электроде выделяется один грамм-эквивалент вещества. Опыт показывает, что число Фарадея F =96494 Кл / г-экв .
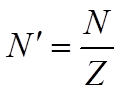 Законы
Фарадея позволяют определить заряд иона. Количес-тво атомов
Законы
Фарадея позволяют определить заряд иона. Количес-тво атомов ![]() в грамм-эквиваленте зависит от валентности
эле-мента и, очевидно, равно
в грамм-эквиваленте зависит от валентности
эле-мента и, очевидно, равно
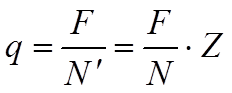 где N – число Авогадро. Таким образом, выделение каждого ато-
где N – число Авогадро. Таким образом, выделение каждого ато-![]()
![]() ма связано с
прохождением через электролит количества электри-чества
ма связано с
прохождением через электролит количества электри-чества
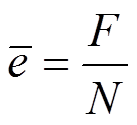 По ионной
теории проводимости электролитов прохождение тока через электролит сводится к
передвижению ионов. Отсюда вытекает, что ион каждого элемента несёт заряд q , пропорцио-нальный
валентности элемента Z. Наименьший заряд иона, соот-ветствует заряду
одновалентного иона ( Z
= 1 ) , отсюда, заряд электрона
По ионной
теории проводимости электролитов прохождение тока через электролит сводится к
передвижению ионов. Отсюда вытекает, что ион каждого элемента несёт заряд q , пропорцио-нальный
валентности элемента Z. Наименьший заряд иона, соот-ветствует заряду
одновалентного иона ( Z
= 1 ) , отсюда, заряд электрона
![]()
![]()
![]()
 |

Лабораторная работа №8
«ОПРЕДЕЛЕНИЕ ЭЛЕКТРОХИМИЧЕС-КОГО ЭКВИВАЛЕНТА ВЕЩЕСТВА,
ЗАРЯДА ИОНА И ЧИСЛА ФАРАДЕЯ»
ЦЕЛЬ РАБОТЫ состоит в ознакомлении с явлением электролиза, определении электрохимического эквивалента меди, заряда двухвале-нтного иона и числа Фарадея.
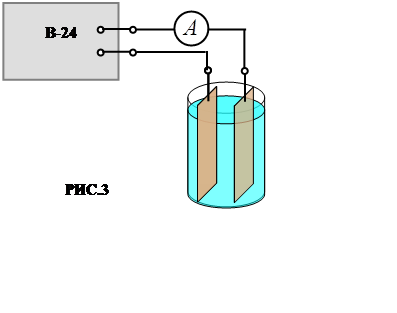
ПРИБОРЫ И МАТЕРИАЛЫ: 1) электролитическая ванна с мед-ными электродами и раствором медного купороса; 2) аналитические весы с разновесами; 3) источник постоянного тока (выпрямитель В-24); 4) амперметр; 5) часы с минутной стрелкой; 6) электроплитка для сушки электродов; 7) соединительные провода.
УПРАЖНЕНИЕ 1. Определение электрохимического экви-валента меди.
· 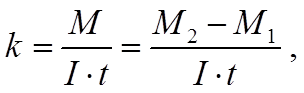 Для
расчёта электрохимического эквивалента вещества используется формула
Для
расчёта электрохимического эквивалента вещества используется формула
где М1 – масса катода до электролиза,
М2 – масса катода после электролиза.
· Взвесить сухой катод и найти его массу в миллиграммах.
· Собрать рабочую схему в соответствии с РИС.3 строго соблю-дая полярность подключения электродов и показать её преподавателю.
·  Вставив в электролитичес-кую ванну запасной катод,
включить источник тока и с помощью регулятора установить в цепи ток 750 мА.
Вставив в электролитичес-кую ванну запасной катод,
включить источник тока и с помощью регулятора установить в цепи ток 750 мА.
· Оставив регулятор в установ-ленном положении, выключить ток в цепи и установить в ванну контрольный (взвешенный на аналитических весах сухой электрод) катод.
· Включить электрическую цепь и одновременно засечь время. Максимально быстро с помощью регулятора откорректиро-вать ток 750 мА и в процессе электролиза поддерживать его постоянным.
· Время электролиза выбрать в пределах 40-50 минут.
· По окончании электролиза одновременно выключить ток и засечь время электролиза.
· Вынуть из ванны катод , отряхнуть его от электролита (выти-рать не следует из-за малой прочности осадка) и высушить на электроплитке.
· Вновь взвесить катод и определить массу выделившейся меди в миллиграммах.
· По полученным данным рассчитать электрохимический экви-валент меди в мг / Кл .
УПРАЖНЕНИЕ 2.
По найденному в упражнении 1 электрохимическому экви-валенту меди рассчитать:
1. Число Фарадея.
2. Заряд двухвалентного иона.
3. Элементарный заряд.
4. Проведите оценку полученных результатов.
По результатам выполненных упражнений оформите письменный отчёт и защитите его у преподавателя.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.