Лекция 14
1 Модель валентного электрона.
2 Квантовый дефект и снятие вырождения по орбитальному квантовому числу.
3 Спектральные серии атомов щелочных металлов
4 Дублетная структура спектральных линий как следствие спин-орбитального взаимодействия.
.
Квантовомеханический расчет сложных атомов, в состав
которых входит несколько электронов, движущихся в поле ядра, является сложной
математической задачей. Однако для атомов щелочных металлов (![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ),
располагающихся в первой группе Периодической системы элементов Д.И.
Менделеева, задача может быть упрощена, а их спектральные свойства могут быть
легко объяснены на основе расчета, аналогичного проведенному при решении задачи
о водородоподобном атоме. Возможность отмеченного упрощения может быть
обоснована следующим образом.
),
располагающихся в первой группе Периодической системы элементов Д.И.
Менделеева, задача может быть упрощена, а их спектральные свойства могут быть
легко объяснены на основе расчета, аналогичного проведенному при решении задачи
о водородоподобном атоме. Возможность отмеченного упрощения может быть
обоснована следующим образом.
Электронные конфигурации атомов щелочных металлов в основном состоянии таковы:
![]()
![]() ;
;
![]()
![]() ;
;
![]()
![]()
и т.д. Общей закономерностью их электронного строения
является то, что совокупность ![]() электронов полностью
заполняет внутренние оболочки атома, (это соответствует электронной
конфигурации атома инертного газа из предыдущего периода системы Д.И.
Менделеева), а один электрон (валентный) расположен во внешней
электронов полностью
заполняет внутренние оболочки атома, (это соответствует электронной
конфигурации атома инертного газа из предыдущего периода системы Д.И.
Менделеева), а один электрон (валентный) расположен во внешней ![]() -оболочке. Известно, что атомы инертных
газов характеризуются высокой устойчивостью, тогда как атомы щелочных металлов
легко ионизируются. Таким образом, электроны внутренних оболочек с общим
отрицательным зарядом
-оболочке. Известно, что атомы инертных
газов характеризуются высокой устойчивостью, тогда как атомы щелочных металлов
легко ионизируются. Таким образом, электроны внутренних оболочек с общим
отрицательным зарядом ![]() вместе с ядром, положительный
заряд которого
вместе с ядром, положительный
заряд которого ![]() , образуют устойчивый «остов»
атома с суммарным зарядом
, образуют устойчивый «остов»
атома с суммарным зарядом ![]() . В поле этого остова,
называемого также эффективным ядром, движется валентный (оптический)
. В поле этого остова,
называемого также эффективным ядром, движется валентный (оптический) ![]() -электрон.
-электрон.
Следовательно, электронное строение атома щелочного
металла имеет аналогию со строением водородоподобного атома, что и позволяет
воспользоваться методикой решения квантовомеханической задачи об атоме водорода
(смотри лекцию 10). Однако при этом следует обратить внимание и на существенное
отличие атома щелочного металла от атома водорода. В атоме водорода
единственный электрон, состояние которого полностью определяет состояние атома,
движется в поле, создаваемом ядром. Поскольку линейные размеры ядра (~10-15
м) во много раз меньше расстояния между электроном и ядром (~10-10
м), то заряд ядра можно считать точечным, а создаваемое им поле – кулоновским
(потенциальная энергия электрона ![]() ). В атоме щелочного
металла поле создается остовом, линейные размеры которого сравнимы с
расстоянием от валентного электрона до ядра.
). В атоме щелочного
металла поле создается остовом, линейные размеры которого сравнимы с
расстоянием от валентного электрона до ядра.
Рассматривая остов как сложную объемную систему с
суммарным зарядом ![]() , потенциальную энергию
валентного электрона в поле эффективного ядра можно представить в виде ряда
, потенциальную энергию
валентного электрона в поле эффективного ядра можно представить в виде ряда
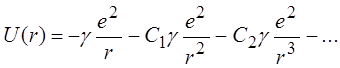 , (14.1)
, (14.1)
первый член которого учитывает кулоновское взаимодействие электронов с ядром; сохранение в (14.1) двух первых членов соответствует так называемому дипольному приближению, трех первых членов – квадрупольному приближению.
Ограничиваясь в первом приближении двумя первыми
членами разложения (14.1) и преобразуя уравнение Шредингера аналогично тому,
как это было сделано для атома водорода, получим для угловой функции ![]() уравнение, полностью совпадающее с (10.4),
а уравнение для радиальной функции
уравнение, полностью совпадающее с (10.4),
а уравнение для радиальной функции ![]() запишем в виде
запишем в виде
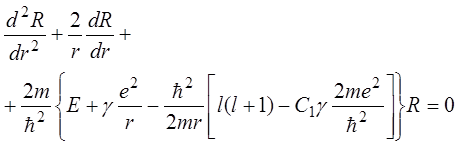 (14.2)
(14.2)
Сравнивая (10.13) и
(14.2), видим, что выражение для потенциальной энергии ![]() содержит
дополнительный член
содержит
дополнительный член 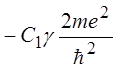 , появившийся в результате учета
второго слагаемого в уравнении (14.1). Уравнения (10.13) и (14.2) формально
тождественны, если положить в (14.2)
, появившийся в результате учета
второго слагаемого в уравнении (14.1). Уравнения (10.13) и (14.2) формально
тождественны, если положить в (14.2)
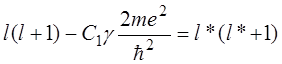 .
(14.3)
.
(14.3)
Разрешив уравнение (14.3) относительно ![]() , получим:
, получим:
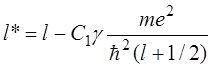 . (14.4)
. (14.4)
Решение уравнения (14.2) с учетом (14.3) приводит к следующему выражению для собственных значений оператора Гамильтона:
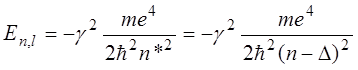 . (14.5)
. (14.5)
Эффективное квантовое число ![]() отличается
от главного квантового числа
отличается
от главного квантового числа ![]() на величину квантового
дефекта
на величину квантового
дефекта ![]() , обусловленного отличием
, обусловленного отличием ![]() от
от ![]() (смотри
формулу (14.4)). Действительно,
(смотри
формулу (14.4)). Действительно,
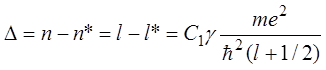 , (14.6)
, (14.6)
поэтому энергия электрона в атоме щелочного металла
отличается от энергии электрона, находящегося на ![]() - уровне
в атоме водорода.
- уровне
в атоме водорода.
Существенно, что наименьшее из значений ![]() всегда больше единицы; например, для
всегда больше единицы; например, для ![]()
![]() =1,63, для
=1,63, для ![]()
![]() =1,80 и т.д. Поэтому
потенциалы ионизации и резонансные потенциалы щелочных металлов значительно
меньше, чем у водорода.
=1,80 и т.д. Поэтому
потенциалы ионизации и резонансные потенциалы щелочных металлов значительно
меньше, чем у водорода.
Заметим, что квантовый дефект ![]() определяется
орбитальным квантовым числом
определяется
орбитальным квантовым числом ![]() . Это означает, что в
атоме щелочного металла энергия валентного электрона зависит не только от
главного квантового числа
. Это означает, что в
атоме щелочного металла энергия валентного электрона зависит не только от
главного квантового числа ![]() , но и от орбитального
квантового числа
, но и от орбитального
квантового числа ![]() , на что в выражении (14.5)
указывает индекс
, на что в выражении (14.5)
указывает индекс ![]() . Таким образом, наличие квантового
дефекта приводит к снятию вырождения энергетических уровней электрона по
орбитальному квантовому числу
. Таким образом, наличие квантового
дефекта приводит к снятию вырождения энергетических уровней электрона по
орбитальному квантовому числу ![]() . Поскольку при заданном
. Поскольку при заданном
![]() орбитальное квантовое число принимает
орбитальное квантовое число принимает ![]() различных значений (
различных значений (![]() 1, 2, …,
1, 2, …, ![]() ), то
степень вырождения по
), то
степень вырождения по ![]() любого
любого ![]() -уровня
равна
-уровня
равна ![]() , то есть уровень
, то есть уровень ![]() для
атома щелочного металла расщепляется на
для
атома щелочного металла расщепляется на ![]() компонент
компонент
![]() .
.
Воспользуемся формулами (14.5) и (14.6) и в качестве примера рассмотрим схему энергетических уровней атома лития.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.