ТЕОРИЯ БОРА ДЛЯ ВОДОРОДОПОДОБНЫХ АТОМНЫХ СИСТЕМ
Цель занятия: Научиться решать задачи с применением основных положений теории Бора для водородоподобных атомных систем.
Водородоподобная атомная система состоит из положительно заряженного ядра и одного электрона, движущегося вокруг ядра по замкнутой траектории (орбите). Теория Бора базируется на законах классической механики и квантовых постулатах Бора, согласно которым:
1.
Атомы и атомные системы могут длительное время, не излучая и не поглощая
энергии, находиться в стационарных состояниях, которым соответствуют
значения энергии ![]() , образующие дискретный ряд.
, образующие дискретный ряд.
2.
Переходя из стационарного состояния с энергией ![]() в
состояние с энергией
в
состояние с энергией ![]() , атом излучает или поглощает
квант электромагнитного излучения, частота которого определяется правилом
частот Бора
, атом излучает или поглощает
квант электромагнитного излучения, частота которого определяется правилом
частот Бора
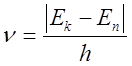 ,
,
где ![]() -
постоянная Планка.
-
постоянная Планка.
3.
Электрон может находиться только на таких орбитах, при движении по
которым он имеет момент количества движения, кратный приведенной постоянной
Планка 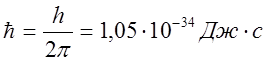 :
:
![]() ,
, ![]()
где ![]() -
масса электрона,
-
масса электрона, ![]() - его скорость,
- его скорость, ![]() - радиус
- радиус ![]() -й
орбиты.
-й
орбиты.
Энергия электрона,
находящегося в ![]() -м стационарном состоянии,
определяется формулой
-м стационарном состоянии,
определяется формулой
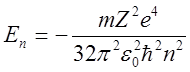 ,
,
где Z
– порядковый номер химического элемента в Периодической системе Д.И.
Менделеева, ![]() Ф/м – диэлектрическая постоянная.
Ф/м – диэлектрическая постоянная.
Спектральные линии, соответствующие квантовым переходам с излучением или поглощением энергии, могут быть объединены в спектральные серии. При этом длина волны электромагнитного излучения, испускаемого или поглощаемого атомом, определяется по обобщенной формуле Бальмера:
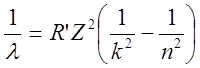 ,
,
где ![]() м-1
– постоянная Ридберга. Квантовой число
м-1
– постоянная Ридберга. Квантовой число ![]() определяет
спектральную серию. Переходам из возбужденных состояний атома в основное
(нормальное) состояние, для которого
определяет
спектральную серию. Переходам из возбужденных состояний атома в основное
(нормальное) состояние, для которого ![]() , соответствуют
спектральные линии, объединенные в серию Лаймана. При
, соответствуют
спектральные линии, объединенные в серию Лаймана. При ![]() и
и
![]() регистрируется серия Бальмера. Значениям
регистрируется серия Бальмера. Значениям ![]() и
и ![]() отвечает
серия Пашена,
отвечает
серия Пашена, ![]() и
и ![]() - серия
Брэкета,
- серия
Брэкета, ![]() и
и ![]() - серия
Пфунда,
- серия
Пфунда, ![]() и
и ![]() - серия
Хэмфри и т.д.
- серия
Хэмфри и т.д.
Частоту излучения
можно выразить через волновое число 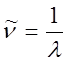 по
формуле
по
формуле ![]() , где
, где ![]() -
скорость света в вакууме. Тогда обобщенную формулу Бальмера можно записать в
виде:
-
скорость света в вакууме. Тогда обобщенную формулу Бальмера можно записать в
виде:
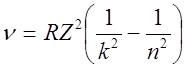 ,
,
где ![]() с-1.
с-1.
1.1.
Основываясь на модели атома, предложенной Бором, получите формулы,
определяющие радиус ![]() -й орбиты и скорость движения
электрона в этом состоянии в водородоподобном атоме. Постройте графики
зависимости скорости электрона и радиуса его орбиты от номера квантового
состояния.
-й орбиты и скорость движения
электрона в этом состоянии в водородоподобном атоме. Постройте графики
зависимости скорости электрона и радиуса его орбиты от номера квантового
состояния.
1.2.
Выведите формулы для потенциальной, кинетической и полной энергии
электрона, движущегося по ![]() -й орбите в
водородоподобном атоме.
-й орбите в
водородоподобном атоме.
1.3.
Вычислите радиусы первой и второй боровских орбит для электрона,
движущегося в атоме водорода и ионах ![]() ,
, ![]() . Сравните результаты. Постройте график зависимости
. Сравните результаты. Постройте график зависимости
![]() .
.
1.4.
Определите частоту ![]() вращения электрона по
второй боровской орбите атома
водорода.
(Ответ:
вращения электрона по
второй боровской орбите атома
водорода.
(Ответ: ![]() с-1)
с-1)
1.5.
Определите кинетическую, потенциальную и полную энергию электрона,
движущегося по первой боровской орбите в атоме водорода и ионах ![]() ,
, ![]() .
Сравните результаты.
.
Сравните результаты.
1.6. Вычислите наибольшую и наименьшую длины волн спектральных линий водорода: а) в видимой области спектра; б) в ультрафиолетовой области спектра; в серии Пашена.
(Ответы ![]() м,
м, ![]() м;
м; ![]() м,
м, ![]() м;
м; ![]() м,
м, ![]() м)
м)
1.7. Определите: а)
потенциал ионизации атома водорода; б) первый потенциал возбуждения атома
водорода; в) энергию ионизации атома водорода из первого возбужденного
состояния. (Ответы: 13,6 В; 10,2
В; ![]() )
)
1.8. Какой серии
принадлежит спектральная линия атомарного водорода, волновое число которой
равно разности волновых чисел следующих двух линий: 486,1 нм; 410,2 нм? Какова
длина волны этой линии? (Ответ:
![]() м)
м)
2.1. Вычислите энергию фотона, испускаемого при переходе электрона в атоме водорода с третьего энергетического уровня на первый. (Ответ: 12,1 эВ)
2.2. Определите наибольшую и наименьшую энергии фотонов в серии Лаймана атома водорода. (Ответы: 10,2 эВ; 13,6 эВ)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.