![]() - орбитальный момент i
–го электрона остова.
- орбитальный момент i
–го электрона остова.
Затем
суммарный момент импульса остова ![]() складывается с
орбитальным моментом импульса внешнего электрона
складывается с
орбитальным моментом импульса внешнего электрона ![]() :
:
![]() ;
;
и
на последнем этапе полученный момент импульса ![]() складывается
со спиновым моментом импульса внешнего электрона
складывается
со спиновым моментом импульса внешнего электрона ![]()
![]() :
:
![]() .
.
Такой тип связи относится к смешанным и называется (J - l) связью.
Рассмотрим подробнее сложение моментов импульса
согласно (J - l) связи. Сложение суммарного
момента импульса остова ![]() с орбитальным моментом
импульса внешнего электрона
с орбитальным моментом
импульса внешнего электрона ![]() дает модуль момента
импульса
дает модуль момента
импульса ![]() , возможные значения которого определяются
квантовым числом
, возможные значения которого определяются
квантовым числом
![]() ,
,
а
сложение момента импульса ![]() со спиновым моментом
импульса внешнего электрона
со спиновым моментом
импульса внешнего электрона ![]() дает модуль момента
импульса
дает модуль момента
импульса ![]() , возможные значения которого определяются
квантовым числом
, возможные значения которого определяются
квантовым числом
![]() .
.
В частности, в случае внешнего электрона в pоболочке и
исходного терма ![]() (
(![]() )
получаем следующую схему:
)
получаем следующую схему:
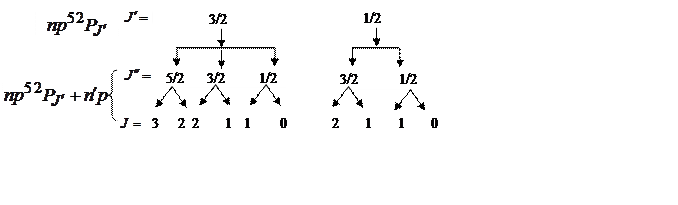
Для уровней с заданными значениями ![]() и
и ![]() в
случае связи (J - l) принято следующее
сокращенное обозначение по следующей схеме. Сперва указывают символ внешнего
электрона: со штрихом - при
в
случае связи (J - l) принято следующее
сокращенное обозначение по следующей схеме. Сперва указывают символ внешнего
электрона: со штрихом - при ![]() и без штриха - при
и без штриха - при ![]() . Затем в квадратных скобках дается
значение
. Затем в квадратных скобках дается
значение ![]() и, наконец, при помощи индекса справа
внизу указывается значение J. Таким образом,
и, наконец, при помощи индекса справа
внизу указывается значение J. Таким образом, ![]() -
обозначение энергетического уровня со значениями
-
обозначение энергетического уровня со значениями ![]() ,
возникающего из уровня 2P3/2 остова
при нахождении внешнего электрона в 4p –
оболочке. Обозначение
,
возникающего из уровня 2P3/2 остова
при нахождении внешнего электрона в 4p –
оболочке. Обозначение ![]() относится к уровню со значениями
относится к уровню со значениями
![]() , возникающего из уровня 2P1/2 остова при нахождении внешнего электрона в 5d
– оболочке.
, возникающего из уровня 2P1/2 остова при нахождении внешнего электрона в 5d
– оболочке.
В качестве примера на рисунке 1 приведено расположение
энергетических уровней для конфигурации 3p54pатома
аргона. Все уровни группируются в пары по значениям ![]() .
Исключения составляют уровни с
.
Исключения составляют уровни с ![]() , для которых уровни с
, для которых уровни с ![]() и
и ![]() лежат
весьма далеко друг от друга. Аналогичная картина наблюдается и для других
конфигураций.
лежат
весьма далеко друг от друга. Аналогичная картина наблюдается и для других
конфигураций.
Благодаря очень высоким значениям энергии возбуждения
спектр атомов инертных газов распадается на спектр, лежащий в далекой
ультрафиолетовой области и получающийся при переходах с высоких возбужденных
уровней на основной уровень ![]() , и на спектр, лежащий в
инфракрасной, видимой и близкой ультрафиолетовой областях и получающийся при
переходах между возбужденными уровнями. Благодаря большому числу таких уровней,
этот спектр весьма сложен. Схемы энергетических уровней и квантовых переходов
для различных инертных газов очень схожи между собой и отличаются в основном
лишь уменьшением масштаба энергетической шкалы при увеличении порядкового
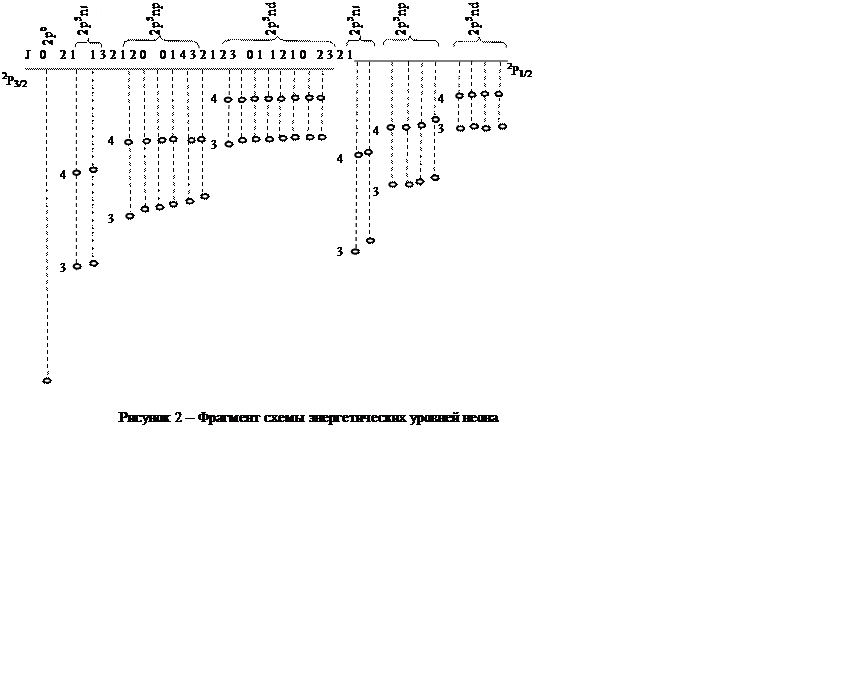
номера в Периодической системе элементов. На рисунке 2 приведена схема
энергетических уровней и отдельных переходов в ней для атома неона.
, и на спектр, лежащий в
инфракрасной, видимой и близкой ультрафиолетовой областях и получающийся при
переходах между возбужденными уровнями. Благодаря большому числу таких уровней,
этот спектр весьма сложен. Схемы энергетических уровней и квантовых переходов
для различных инертных газов очень схожи между собой и отличаются в основном
лишь уменьшением масштаба энергетической шкалы при увеличении порядкового
номера в Периодической системе элементов. На рисунке 2 приведена схема
энергетических уровней и отдельных переходов в ней для атома неона.

В соответствии с наличием у остова атомов инертных
газов, т.е. у однократно заряженных ионов, дублетного терма ![]() , состоящего из двух уровней
, состоящего из двух уровней ![]() и
и ![]() ,
граница ионизации для этих атомов является двойной. Часть возбужденных уровней
сходится к границе
,
граница ионизации для этих атомов является двойной. Часть возбужденных уровней
сходится к границе ![]() , часть уровней – к границе
, часть уровней – к границе ![]() , лежащей выше на величину дублетного
расщепления.
, лежащей выше на величину дублетного
расщепления.
Порядок выполнения работы
1.Собрать и отъюстировать оптическую систему, состоящую из ртутной лампы, конденсора и монохроматора УМ-2.
2.Изменяя ширину входной щели и фокусировку окуляра, получить качественное изображение спектра ртути.
3.Используя атлас спектра ртути, произвести градуировку монохроматора. Построить градуировочный график.
4.Заменить ртутную лампу разрядной трубкой, заполненной парами инертных газов (неона, криптона, ксенона), определить положение спектральных линий каждого из этих газов относительно шкалы прибора и найти с помощью градуировочного графика их длины волн.
 5.С помощью схем
энергетических уровней неона, криптона, ксенона произвести отнесение его
наблюдаемых спектральных линий к спектральным сериям.
5.С помощью схем
энергетических уровней неона, криптона, ксенона произвести отнесение его
наблюдаемых спектральных линий к спектральным сериям.
6.Изобразить фрагмент схемы энергетических уровней и наблюдаемые в эксперименте квантовые переходы для каждого из изучаемых инертных газов.
7.Определить значение квантового дефекта для заданного преподавателем инертного газа.
Литература
5. Практикум по спектроскопии. Под ред. Л.В. Левшина.
6. Э.В.Шпольский Атомная физика. Т.2.
7. М.А.Ельяшевич. Атомная и молекулярная спектроскопия.
8. С.Э.Фриш. Оптические спектры атомов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.