













Лекция 3
ТЕОРИЯ МЕЖИОННОГО ВЗАИМОДЕЙСТВИЯ
ВВЕДЕНИЕ ПОНЯТИЙ ОБ АКТИВНОСТИ И О КОЭФФИЦИЕНТЕ АКТИВНОСТИ
Можно найти известную аналогию в развитии теории растворов электролитов и теории газового агрегатного состояния. В том и другом случаях первоначально предполагалось, что система ведет себя подобно идеальной и что между образующими ее частицами нет сил взаимодействия. Приложение полученных на основе таких представлений законов к реальным системам приводило к значительным расхождениям между теорией и опытом. В связи с этим вместо простого уравнения газового состояния
![]()
предлагались другие, более сложные, в которых так или иначе учитывались силы взаимодействия между частицами. Одним из них было уравнение Ван-дер-Ваальса
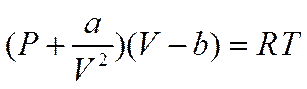
в котором а и b— поправки соответственно на силы взаимного притяжения и на конечный объем частиц газа или, в первом приближении, на силы отталкивания.
По такому же пути могло бы пойти и развитие теории растворов. Однако она развивалась совершенно иначе. А именно, форма уравнений, описывающих свойства растворов, была сохранена неизменной, но применимость этих уравнений к реальным системам достигалась тем, что в них вместо обычных величин, характеризующих системы (давления, концентрации), стали использовать величины, заимствованные из опыта. Так, упругость пара заменяется на величину, названную летучестью, или фугативностью, а концентрация — на величину, названную активностью. По Льюису, например, чтобы уравнение (I-20), определяющее константу диссоциации слабой кислоты и справедливое для идеальных систем, было применимо и к реальным системам, нужно переписать его следующим образом:
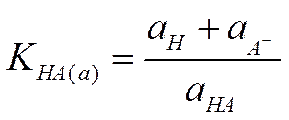 (I I - 1)
(I I - 1)
Нетрудно видеть, что это уравнение совпадает по форме с уравнением (I-20) и тем не менее оно правильно описывает поведение реального раствора. Это достигается благодаря тому, что в уравнение (II-1) в отличие от уравнения входят не концентрации ионов с+ и с- и недиссоциированных молекул электролита са, а соответствующие активности а+, а- и аа. Значения активностей выбираются так, чтобы величина константы диссоциации оставалась постоянной.
Распределение ионов в растворе по Аррениусу и Гхошу.
Третий постулат теории Аррениуса определяет растворы электролитов как идеальные системы. В соответствии с этим предполагают, что ионы в растворах расположены беспорядочно и силы взаимодействия между ними равны нулю. Подобное предположение приводит (независимо от состава раствора) к одному единственному значению коэффициента активности, а именно— к величине f±, равной единице. Такое заключение противоречит опыту и указывает на нереальность модели раствора, предложенной Аррениусом.
Иной взгляд на природу растворов электролитов был высказан индийским ученым Гхошем (1918 — 1920). По теории Гхоша ионы в растворе располагаются в том же строгом порядке, в каком они находятся в кристаллической решетке соответствующего твердого тела. Различие заключается главным образом в том, что расстояния между двумя соседними ионами оказываются в растворе большими, чем в исходном кристалле. Процесс растворения отождествляется при этом с набуханием. Пространство между ионами заполняется молекулами растворителя, и силы взаимодействия ослабляются вследствие увеличения диэлектрической постоянной и межионного расстояния. Силы взаимодействия между ионами обладают электростатической кулоновской природой.
При помощи этих и ряда других постулатов Гхошу удалось вывести формулы для расчета свободной энергии раствора, коэффициента активности, теплот разбавления и т. п. В области умеренных концентраций эти формулы находятся в качественном согласии с опытом. Однако предпосылки теории Гхоша не согласуются с современными данными о строении растворов и многие ее выводы противоречат опытным фактам. Так, например, из нее следует, что потенциальная энергия раствора зависит от температуры лишь в той степени, какая отвечает изменению диэлектрической постоянной раствора. В действительности же потенциальная энергия раствора зависит непосредственно от температуры. Результаты рентгеновских и других методов исследования структуры растворов не подтверждают мысли Гхоша о сохранении в растворах электролитов кристаллической решетки исходных соединений. Противоречия между теорией Гхоша и опытом следует отнести в первую очередь за счет того, что в теории не учитывается роль теплового движения, которое в растворах должно нарушать упорядоченное расположение ионов, подобное их расположению в кристалле.
Теория Дебая и Гюккеля
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.