


































Лекция 8
МЕХАНИЗМОБРАЗОВАНИЯЭ. Д. С. ИПРИРОДАЭЛЕКТРОДНОГО
§ 1. Скачкипотенциала, встречающиесявэлектрохимических системах
Скачки потенциала могут возникать на границе раздела любых двух фаз, хотя механизм их образования в каждом случае не обязательно одинаков, а зависит от природы граничащих фаз. В электрической системе (рис. 23) можно найти:
а) твердые металлические фазы — оба электрода и внешнюю цепь;
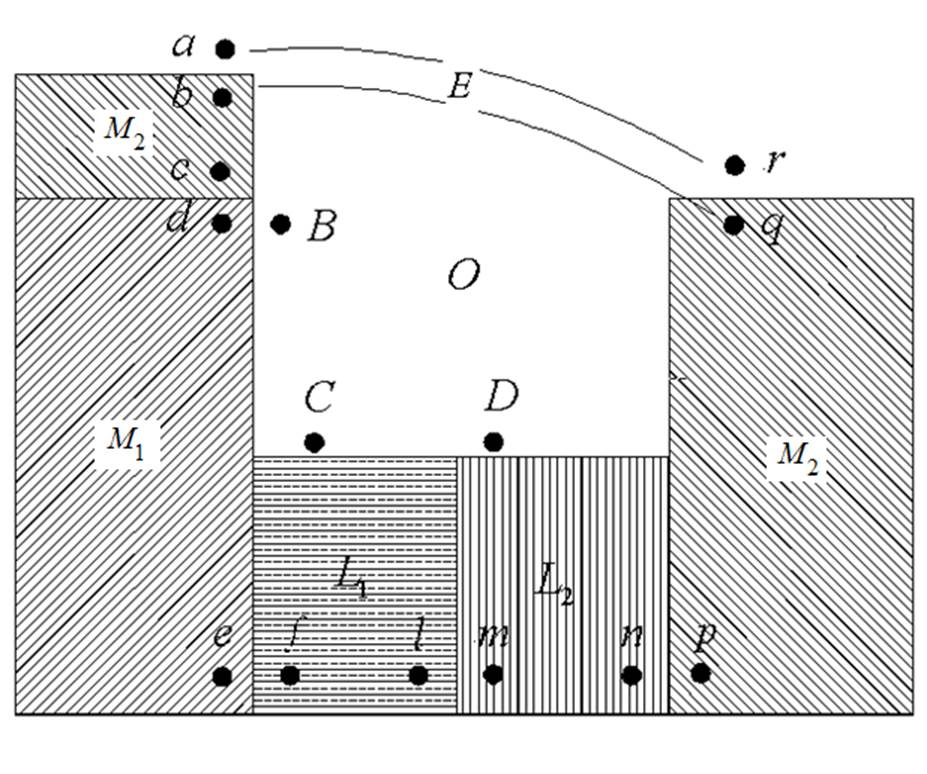
Рис. 23 Характеристика фазового состава электрохимической системы с указанием локализации возможных скачков потенциала: М1 и М2 - металлы электродов; L1 и L2 - растворы, О - газовая фаза
б) жидкие фазы — растворы, примыкающие к электродам; они могут давать или две фазы, если электролит растворен в двух несмешивающихся между собой растворителях, или одну фазу, когда растворитель один и тот же, например вода;
в) газовую фазу, граничащую с растворами и с электродами (по свойствам близкую к вакууму).
Как известно, разность потенциалов между двумя точками определяется той электрической работой, которую необходимо совершить, чтобы перенести элементарный электрический заряд из одной точки в другую. Если обе точки лежат в одной и той же фазе, то работа переноса заряда будет только электрической, и потенциал между выбранными точками можно или определить, или вычислить. Если же точки лежат в двух разных фазах, то перенос элементарной частицы электричества из одной точки в другую будет связан не только с электрической работой, но также и с химической, ибо химические потенциалы этой частицы в разных фазах неодинаковы. Энергетическое состояние заряжённой частицы характеризуется поэтому в общем случае суммой химического потенциала и ее электрической энергии в данной фазе
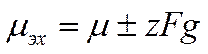 (IX-1)
(IX-1)
Величина μэх называется электрохимическим потенциалом, a g отвечает разности потенциалов между точкой внутри фазы и бесконечно удаленной точкой в вакууме. Условием равновесия для заряженных частиц в двухфазной системе с фазами / и 2 будет равенство их электрохимических потенциалов
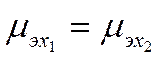 (IX-2)
(IX-2)
Скачки потенциала между точками a и b и q и r следует отнести к поверхностным потенциалам между металлом Μ и вакуумом О; их можно обозначить соответственно через χом2 и χм2о- Естественно, что
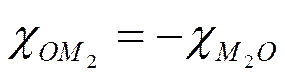
Скачок потенциала между точками c и d, расположенными в металлических фазах М2 и Μ1; представляет собой разность соответствующих внутренних потенциалов —gM2M1· Точки е—а и n—p — это места, где локализуются разности внутренних потенциалов: металл 1 — раствор 1 и раствор 2 — металл 2; их следует записывать соответственно gM1L1 и gL2M2 . Разность внутренних потенциалов называется гальвани-потенциалом;gLM — потенциалы часто называют также нернстовскими и обозначают, как и электродный потенциал, буквой ε. Наконец, скачок потенциала между точками l и m является гальвани-потенциалом между растворами l1 и L2 и записывается как gL1L2 . Здесь следует различать два случая. Если растворы l1 и L2 отвечают двум различным несмешивающимся растворителям, то gL1L2 будет гальвани-потенциалом между двумя жидкостями или фазовым жидкостным потенциалом. Если же растворы l1 и L2 отличаются друг от друга природой или концентрацией электролита, но не природой растворителя, то этот потенциал будет диффузионным потенциалом; его обозначают обычно как ψd.
Таким образом э.д.с. электрохимической системы представляет собой сумму следующих скачков потенциала:
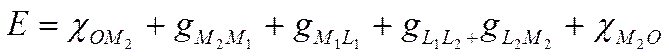 (IX-10)
(IX-10)
или, после сокращения одинаковых слагаемых с учетом их знаков.
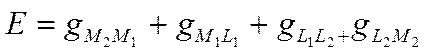 (IX-11)
(IX-11)
Следовательно, э.д.с. электрохимической системы состоит из четырех скачков потенциала: гальвани-потенциала между двумя металлами, двух нернстовских потенциалов и гальвани-потенциала раствор—раствор. Во многих электрохимических системах контактный потенциал gL1L2 или отсутствует, или его можно свести до минимума. Он не является, таким образом, неизбежным следствием природы электрохимической системы и обязательным слагаемым ее э.д.с. Поэтому э.д.с. обычно выражают как сумму трех скачков потенциала
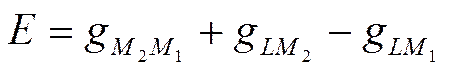 (IX-12)
(IX-12)
В современной электрохимии электродный потенциал ε приравнивают э.д.с. цепи, в которой слева находится стандартный водородный электрод с величиной потенциала, условно принятой за нуль, а справа - данный электрод. В этом случае левым электродом (или металлом 1) служит платина, и выражением э.д.с. такой цепи (так же как и электродного потенциала металла 2) будет
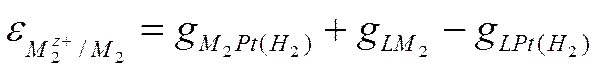 (IX-13)
(IX-13)
Таким образом, электродный потенциал ε (так же как и э.д.с. Е) состоит из трех скачков потенциала и включает в себя гальвани-потенциал на границе электродного металла 2 и платины.
МЕЖДУНАРОДНАЯ КОНВЕНЦИЯ ОБ Э. Д. С. И ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛАХ
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.