



















Лекция 6.
КОНДУКТОМЕТРИЯ
Классическая кондуктометрия
Величина электропроводности растворов имеет большое значение для протекания электрохимических процессов. На ее основе можно сделать рациональный выбор состава электролита. Кондуктометрия находит самое широкое применение как метод химического анализа, производственного контроля и научного исследования. Она обладает рядом преимуществ перед химическими методами анализа, так как позволяет определить содержание индивидуального вещества в растворе простым измерением электропроводности раствора. Для этого нужно только иметь предварительно вычерченную калибровочную кривую зависимости электропроводности от концентрации вещества. Кроме того, в процессе измерения электропроводности анализируемый раствор практически не изменяется, благодаря чему можно проводить повторные измерения и, сохранив его, в любое время проверить полученные результаты.
Кондуктометрический метод анализа — один из наиболее точных способов определения растворимости трудно растворимых соединений. Он основан на измерении электропроводности жидкой фазы, находящейся в равновесии с соответствующим твердым соединением. Если известны подвижности ионов, на которые диссоциирует данное трудно растворимое соединение, то, определив удельную электропроводность раствора, можно вычислить его концентрацию по уравнению
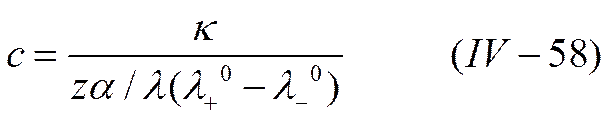
коэффициент электропроводности fλ –эмпирический фактор. Если соль трудно растворима, т. е, ее концентрация в растворе очень мала, степень диссоциации α и коэффициент электропроводности fλ, можно считать равными единице, а подвижности ионов в данном растворе λ+ и λ_ —ионным подвижностям при бесконечном разведении λ°+ и λ°-. Зная концентрацию с, легко найти и растворимость соединения. Кондуктометрия используется также для определения констант равновесия химических реакций в растворах, основности кислот и т. п.
Кондуктометрическое титрование, в отличие от обычного, не требует применения индикаторов и может быть проведено в окрашенных, а также в очень разбавленных растворах. В процессе титрования за ходом реакции следят, измеряя электропроводность титруемого раствора после каждого нового прибавления титрующего реагента. Конец титрования совпадает с перегибом на кривой электропроводность- объем добавленного раствора. Изменение электропроводности при кондуктометрическом титровании связано с заменой в растворе, по мере протекания реакции, одних ионов на другие с иной ионной подвижностью.
Пусть имеется раствор щелочи, который необходимо оттитровать кислотой. Предположим, что взят раствор, содержащий а г-экв NaOH. Его электропроводность определяется подвижностями ионов Na+ и ОН-, равными при 25° С соответственно 50,1 и 197,6. К этому раствору прибавляют порцию титрующего раствора, содержащего x г-экв НСl. Если x<a, то произойдет частичная нейтрализация щелочи кислотой
![]() Неполная нейтрализация приведет к тому, что в титруемом растворе останется
(а — х) г-экв NaOH и появится x г-экв NaCl в виде
ионов Na+ и С1- с подвижностями соответственно 50,1 и 76,3.
Таким образом, часть гидроксильных ионов заменится на менее подвижные ионы
хлора и электропроводность раствора упадет. Так будет происходить при
прибавлении каждой новой порции раствора соляной кислоты до тех пор, пока не
наступит точка эквивалентности, в которой все ионы ОН- щелочи будут
заменены ионами Cl-. При дальнейшем прибавлении титрующего раствора (сверх точки
эквивалентности) кислота уже не будет связываться щелочью. Вся щелочь окажется
полностью нейтрализованной, и в титруемом растворе (наряду с ионами хлора)
появятся также свободные ионы водорода с очень высокой подвижностью, равной
349,8.
Неполная нейтрализация приведет к тому, что в титруемом растворе останется
(а — х) г-экв NaOH и появится x г-экв NaCl в виде
ионов Na+ и С1- с подвижностями соответственно 50,1 и 76,3.
Таким образом, часть гидроксильных ионов заменится на менее подвижные ионы
хлора и электропроводность раствора упадет. Так будет происходить при
прибавлении каждой новой порции раствора соляной кислоты до тех пор, пока не
наступит точка эквивалентности, в которой все ионы ОН- щелочи будут
заменены ионами Cl-. При дальнейшем прибавлении титрующего раствора (сверх точки
эквивалентности) кислота уже не будет связываться щелочью. Вся щелочь окажется
полностью нейтрализованной, и в титруемом растворе (наряду с ионами хлора)
появятся также свободные ионы водорода с очень высокой подвижностью, равной
349,8.
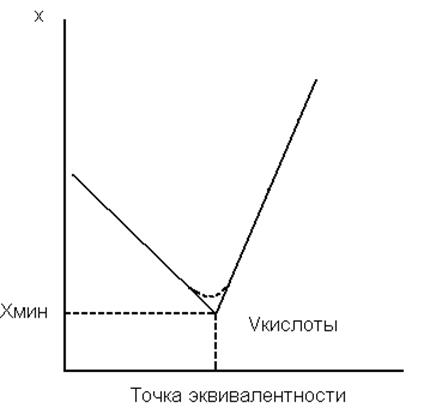
Рис.14. Кривая кондуктометрического титрирования раствора щелочи раствором кислоты.
Это приведет к резкому подъему электропроводности (рис. 14). Точка минимума на кондуктометрической кривой является точкой эквивалентности и отвечает электропроводности хлорида натрия. Из объема кислоты, израсходованной до достижения точки минимума, легко вычислить содержание щелочи в титруемом растворе. Приведенный пример показывает, что чувствительность кондуктометрического титрования в очень сильной степени зависит от разности в подвижностях связываемых и появляющихся ионов, причем она будет тем выше, чем больше эта разница. При кондуктометрическом титровании следует учитывать не только то, насколько полно протекает основная реакция; большое значение имеют также подвижности ионов, не принимающих в ней прямого участия.
Кондуктометрическое титрование отличается от обычного также тем, что дает не одну только точку (точку нейтрализации, связанную с изменением окраски раствора и совпадающую с минимумом на кривой κ — V), а полную кривую всего процесса титрования. Кондуктометрический метод производственного контроля интересен тем, что изменение состояния контролируемой системы проявляется в виде электрических импульсов. Электрические импульсы могут быть переданы непосредственно исполнительному механизму, что облегчает автоматическое управление процессом. Электропроводность раствора зависит от всех присутствующих в нем компонентов и является поэтому интегральным свойством системы. Сочетание измерения электропроводности с определением какого-либо другого интегрального (например, плотности) или специфического (например, величины рН) свойства раствора позволяет осуществить совершенную схему автоматического регулирования. Кондуктометрия используется с успехом для контроля за операциями отмывки осадков, регенерации ионообменных смол, очистки воды и за многими другими технологическими процессами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.