На границе раздела двух фаз можно выделить пограничный слой, так называемую поверхностную или пограничную фазу. Она обладает избытком свободной энергии по сравнению с каждой из граничащих фаз. Избыточная энергия, отнесенная к единице поверхности раздела фаз, т. е. удельная свободная энергия, называется поверхностным натяжением σ и имеет размерность эрг· см-2 или дин·см-1. Часто ее рассматривают как величину, характеризующую избыток сил взаимного притяжения над силами отталкивания. Величина избыточной поверхностной энергии зависит от разности потенциалов между двумя фазами. Электрокапиллярные явления отражают связь, существующую между поверхностным натяжением и разностью потенциалов на границе двух фаз. Графически эта связь выражается в виде так называемых электрокапиллярных кривых. Впервые электрокапиллярные явления были исследованы на границе ртути и водных растворов электролитов Липпманом (1875), который использовал для этой цели сконструированный им капиллярный электрометр. В дальнейшем его исследования были продолжены Гуи (1910) и Фрумкиным (1919), а также Батлером, Крюгером, Грэмом, Парсонсом и др.
При снятии электрокапиллярных кривых с помощью капиллярного электрометра на ртутный микроэлектрод, находящийся в капилляре и контактирующий с раствором, подается определенный потенциал и измеряется высота столба ртути, удерживаемого в стеклянной трубке над ртутным мениском в капилляре. Потенциал на границе между раствором и ртутью в капилляре задается наложением определенной э.д.с. (например от потенциометрической установки) на электрохимическую систему, в которой одним электродом служит капиллярный электрод, а другим — соответствующий электрод сравнения с известным значением потенциала При этом электрод сравнения, как неполяризуемый, сохраняет неизменное значение потенциала, а идеально поляризуемый капиллярный ртутный электрод принимает значение потенциала, отвечающее приложенной внешней э.д.с.*). Как это следует из теории капиллярности, высота ртутного столба над ртутным мениском в капилляре является мерой поверхностной энергии на границе ртуть —раствор. Соотношение между этими двумя величинами можно записать в виде уравнения
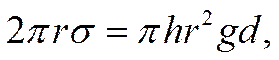
![]()
откуда
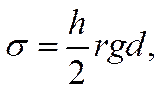
![]()
где r — радиус капилляра; g — ускорение силы тяжести; d — плотность ртути. Измеряя высоту h при различных значениях потенциала и рассчитывая по уравнению (Х-6) соответствующие ей величины σ, можно построить электрокапиллярную кривую. Для ряда разбавленных растворов (например, H2SO4, КОН, KNO3. Na2SO4 и др.) форма электрокапиллярной кривой почти не зависит от природы электролита и близка к параболе. Максимум на кривой наблюдается при этом примерно при одном и том же значении потенциала, лежащем между —0,19 и —0,21 в по водородной шкале. Поверхностное натяжение в точке максимума также мало изменяется при переходе от одного из указанных растворов к другому и составляет 420—430 эрг см-2. Так, по Гуи при 18° С в 0,01 н. Na2S04 и в чистой воде σ = 426,7 дин см-2. В то же время электрокапиллярные кривые, полученные в растворах других электролитов, а также в присутствии большинства органических неионизированных веществ, сильно отличаются по своей форме от параболы. Они менее симметричны, и их максимумы расположены при иных значениях ε и σ.
На рис. 32, наряду с электрокапиллярными кривыми для электролитов типа KNO3, приведены также кривые, отвечающие тем случаям, когда в растворе присутствуют ионы Br-, I-, S2-, Tl-, N(C3H7)+ или молекулы амилового спирта. Присутствие ионов брома, иода или серы смещает максимум электрокапиллярной кривой в сторону более отрицательных значений потенциалов и (особенно в области потенциалов, расположенных слева от точки максимума) уменьшает поверхностное натяжение. При достаточно отрицательных потенциалах эффект этих анионов исчезает и электрокапиллярные кривые сливаются друг с другом. Присутствие ионов таллия или ионов тетрабутиламмония сдвигает максимум электрокапиллярных кривых в сторону более
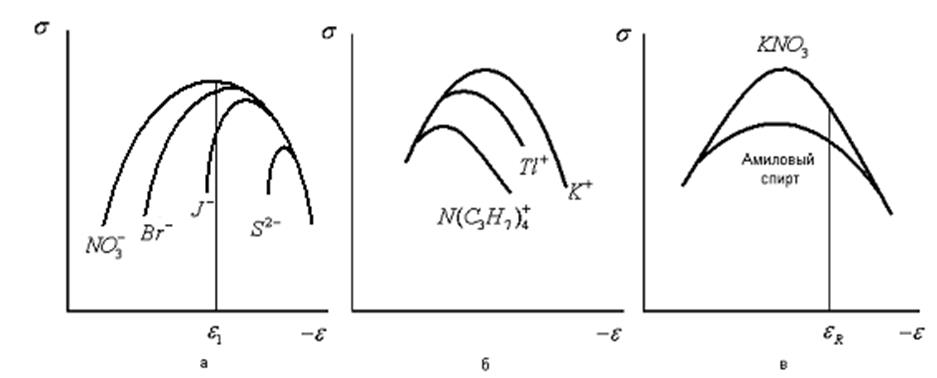
Электрокапиллярные кривые, снятые в растворах, содержащих поверхностноактивные анионы (а), катионы (б) и молекулярные вещества (в)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.