




3. Какое максимальное число электронов может принимать s-, p-,d- и f- орбитали данного энергетического уровня? Почему?
Решение:
|
|
- 2
электрона
|
|
|
|
- 6 электронов
|
|
|
|
|
|
- 10 электронов
|
|
|
|
|
|
|
|
- 14 электронов
Максимальное число электронов в подуровне равно 2*(2*L+1)
L =0 2*(1*0+1)=2
L =1 2*(2*1+1)=6
L =2 2*(2*2+1)=10
L =3 2*(2*3+1)=14
Согласно принципу Паули в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковы.
![]() N – главное Если
n=2
N – главное Если
n=2
L - побочное квантовое число L= 1
ml - магнитное ml= -1, 0,+1
ms - спиновое ms= +1/2, –1/2
1е: n=2, L=1, ml= -1, ms= +1/2
2е: n=2, L=1, ml= -1, ms= -1/2
3е: n=2, L=1, ml= 0, ms= +1/2
4е: n=2, L=1, ml= 0, ms= -1/2
5е: n=2, L=1, ml= +1, ms= +1/2
6е: n=2, L=1, ml= +1, ms= -1/2
В электроне 7 будет повторение одного из квантовых чисел, что противоречит принципу Паули.
Поэтому 7 электрона на p-подуровне быть не может. Рассуждая аналогично можно сделать вывод, что и на s-, d- и f- орбиталях не может быть другого количества электронов.
35. Какие элементы образуют кислотные и основные оксиды? Приведите примеры.
Решение:
Основные оксиды – это оксиды, которым соответствуют основания. Металлы с валентностью меньше IV, как правило, образуют основные оксиды.
CaO, MgO, CuO, Fe2O3
Кислотные оксиды – это оксиды, которым соответствуют кислоты. Неметаллы образуют только кислотные оксиды, а с валентностью более IV- кислотные.
SO3, P2O5, CrO3, CO2, SO3
65. Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г)+O2(г)Яа2NO2(г)
Ответ мотивируйте, вычислив DG0298 прямой реакции, исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ.
Решение:
DG0x.p.= DH0x.p.-TDS0x.p.; DH и DS – функции состояния, поэтому
DH 0x.p.= еDH0обр.(продуктов)- еDH0обр.(исходных веществ),т.е. изменение энтальпии реакции (при стандартных условиях) равно сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
DH0x.p = (2* DH0NO23)-( 2*DH0H2O + DH0O2)
DH0x.p = 2*33.89-(2*90.37) = 67.78-180.74 = -112.96кДж
Вычисляем DS0x.p.= (2* DS0NO23)-( 2*DS0H2O + DS0O2)
DS0x.p. = 2*240.45-(2*210.62+205.03) = 480.9-626.27 = -145.37Дж/моль.град = -0.14537 кДж/моль.град/
Изменение энергии Гиббса при стандартных условиях равно
![]() DG0x.p=-112.96-298*(-0.14537) =
-112.96+43.32 = -69.64 кДж.
DG0x.p=-112.96-298*(-0.14537) =
-112.96+43.32 = -69.64 кДж.
![]() То, что DG0x.p 0 указывает на возможность
самопроизвольного протекания прямой реакции при T = 298 К и равенстве давлений взятых газов 1,013*105
Па.
То, что DG0x.p 0 указывает на возможность
самопроизвольного протекания прямой реакции при T = 298 К и равенстве давлений взятых газов 1,013*105
Па.
101. Что называется раствором?
Решение:
Растворами называют гомогенные однородные системы, состоящие из двух или более компонентов. В зависимости от агрегатного состояния различают газообразные, жидкие и твердые растворы. Примером газообразных растворов является воздух, к твердым раствором относятся многие сплавы металлов. Примерами жидких растворов (вообще их огромное количество) могут служить морская и минеральная вода – растворы в воде различных солей и газов.
143 и,к не существует, поэтому сделали 140 и,к.
Какие из этих реакций идут до конца?
и) CuCl2+ Na2S04 à
к) Na2S04 + Ba(N03)2à
Решение:
и) CuCl2+ Na2S04 àCu S04 + 2NaCl реакция не идет до конца, т.к. продукт реакции не удаляется.
![]() к) Na2S04 + Ba(N03)2à 2Na N03
+ Ba S04
к) Na2S04 + Ba(N03)2à 2Na N03
+ Ba S04
реакция идет до конца, т.к. в результате реакции выпадает осадок.
162. На основе электронного строения атомов укажите, могут ли быть окислителями:
в) фторид ионы;
и) молекулы кислорода;
Решение:
в) Так как типичными окислителями являются простые вещества, атомам которых для завершения валентного уровня не хватает одного, двух или трех электронов. В нашем случае до завершения валентного уровня атому фтора не хватает одного электрона - сильнейший окислитель.
F9 1s22s23p5
и)Так как типичными окислителями являются простые вещества, атомам которых для завершения валентного уровня не хватает одного, двух или трех электронов. В нашем случае до завершения валентного уровня атому кислорода не хватает двух электронов - окислитель.
O8 1s22s23p4
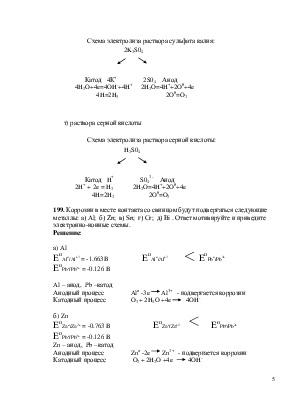
182е,т не существует, поэтому сделали 181. Написать уравнения реакций, происходящих при электролизе следующих растворов:
е) сульфата калия
т) раствора серной кислоты
Решение:
е) сульфата калия
Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионовОНn-. У анода будет идти выделение кислорода и накопление ионов Н+ . В то же время в катодное пространство будут приходить ионы К+, а в анодное – ионы SO--4
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.