




Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Российской Федерации
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)
кафедра МЦМ
ЛАБОРАТОРНАЯ РАБОТА
По дисциплине: металлургия тяжелых металлов
Тема:
ЭЛЕКТРОХИМИЧЕСКОЕ РАФИНИРОВАНИЕ И ЭЛЕКТРОЭКСТРАКЦИЯ МЕДИ
(подпись) (Ф.И.О.)
студент гр. АПМ-03 ____________________ /НадёжкинД.И./
(подпись) (Ф.И.О.)
(подпись) (Ф.И.О.)
Проверил: ________________ /Смирнов Ю.М./
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата: ___________________
Санкт-Петербург
2006 год
Цель работы - определить влияние плотности тока на основные показатели процесса: удельный расход электроэнергии и выход по току.
Электрохимическое рафинирование меди проводят в медно-сернокислых растворах, содержащих небольшое количество хлористых солей. Так как эти растворы представляют собой сильные электролиты, то содержащиеся в них соли и кислоты практически полностью диссоциированы:
Сu2SО4 = 2Сu+ + SО42- Н2SО4 = 2Н+ + SО42-
СuSО4 = Сu2+ + SО42- СuС12 = Сu2+ + 2Сl-
Обычный состав рабочих растворов, г/дм3: Сu2+ 40-50; Н2SО4 150-200;. Сl 0,01-0,04.
Большое содержание Н+ (в виде серной кислоты) обеспечивает высокую электропроводность электролита; добавки хлор-иона необходимы для связывания серебра в нерастворимый осадок (хлористое серебро).
В простых солевых растворах металлическая медь имеет электроположительный потенциал
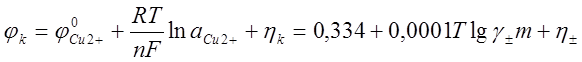
где ![]() - стандартный потенциал меди,
- стандартный потенциал меди, ![]() = 0,337 В; Т - абсолютная
температура, К; F- число Фарадея, F = 96500 Кл; п - количество атомов,
принимающих участие в реакции;
= 0,337 В; Т - абсолютная
температура, К; F- число Фарадея, F = 96500 Кл; п - количество атомов,
принимающих участие в реакции; ![]() - активность катионов
меди, моль/л;
- активность катионов
меди, моль/л; ![]() - перенапряжение выделения
меди при электролизе, В; т - молярная концентрация меди, моль СuSО4/1000г Н2О;
- перенапряжение выделения
меди при электролизе, В; т - молярная концентрация меди, моль СuSО4/1000г Н2О; ![]() - коэффициент активности сульфата меди.
- коэффициент активности сульфата меди.
Значения двух последних составляющих сравнительно невелики и динамический потенциал выделения меди имеет большое положительное значение: около +0,35 В. Это обеспечивает выделение на катоде сравнительно чистого металла с высоким выходом по току. Основная катодная реакция
Си2+ + 2е = Си
Разряд 1 г-экв любого вещества происходит при прохождении 96500 Кл электричества или в технических единицах 26,8 А-ч. Следовательно, теоретически на 1 А-ч будет выделяться 63,54/(2-26,8) = 1,185 г меди, 2-1,008/(2-26,8) = 0,0374 г водорода или регенерироваться 98,06/(2-26,8) = 1,832 г серной кислоты.
Анодный процесс более сложен. В сернокислых средах медь и металлы-примеси окисляются с образованием простых ионов. Например, Си - 2е <=> Си2+.
В
хлористых средах медные ионы образуют комплексные соединения одно- и
двухвалентной меди типа ![]() и
и ![]() . Потенциал меди в растворах
однохлористой меди электроотрицательнее, чем в растворах двухвалентной меди.
Поэтому в хлористых средах растворение анодов протекает с образованием
одновалентной меди по реакции
. Потенциал меди в растворах
однохлористой меди электроотрицательнее, чем в растворах двухвалентной меди.
Поэтому в хлористых средах растворение анодов протекает с образованием
одновалентной меди по реакции
Сu – е = Сu+
и на 1 А-ч растворяется 63,54/26,8 = 2,370 г металлической меди. Если растворы не содержат достаточных количеств кислоты (ионов H+), то образующиеся медные ионы подвергаются гидролизу:
Сu+ + ОН- = СuОН
Сu2+ + 2ОН-=Сu(ОН)2
В щелочных средах и при очень большой плотности тока при электролизе в нейтральных и кислых средах на медном аноде могут разряжаться также ионы гидроксила
4ОН- - 4е = О2 + 2Н2О,
что легко обнаруживается по выделению пузырьков кислорода.
Та же реакция протекает и на свинцовых анодах. Ее потенциал выше, чем потенциал простого растворения меди. Поэтому ванны электролитического обезмеживания работают при напряжении, значительно более высоком, чем ванны электрохимического рафинирования.
В простых сернокислых растворах динамический потенциал медного анода
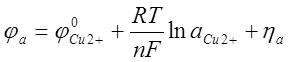
где ![]() - перенапряжение растворения меди, В.
- перенапряжение растворения меди, В.
Поэтому общее напряжение на ванне электрохимического рафинирования
![]()
где 1R - омические потери в электролите, В.
m1= 616.06 г, масса растворимого анода до опыта,
m2=306 г, масса нерастворимого анода до опыта,
I=2.5 A
D1=200 A/м2, для ванны с растворимым анодом (электрорафинирования),
D2=140 A/м2, для ванны с нерастворимым анодом,
b1=0,057 м
b2=0,081 м
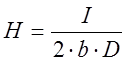 , где H – глубина погружения электрода,
, где H – глубина погружения электрода,
D – средняя плотность тока, А/м2,
I – сила тока, А,
b – ширина электрода, м,
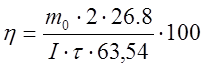 , где
, где ![]() выход по
току, %,
выход по
току, %,
m0 – масса меди, осажденная в рабочей ванне, г,
![]() продолжительность электролиза, ч.
продолжительность электролиза, ч.
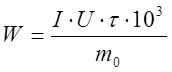 , где W – удельный расход энергии на электролиз, кВт-ч,
, где W – удельный расход энергии на электролиз, кВт-ч,
U – среднее напряжение на ванне, В.
|
|
I, AРаств. Нераств |
U, BРаств. Нераств. |
|
|||
0 |
3 |
3 |
0,7 |
9,6 |
38 |
36 |
15 |
3 |
3 |
0,8 |
9,8 |
38 |
34 |
30 |
3 |
3 |
0,8 |
9,8 |
36 |
32 |
45 |
3 |
3 |
0,8 |
9,7 |
35 |
32 |
60 |
3 |
3 |
0,9 |
9,7 |
34 |
31 |
75 |
3 |
3 |
0,95 |
9,8 |
33 |
30,5 |
90 |
3 |
3 |
0,9 |
9,8 |
32 |
30 |
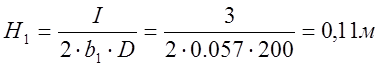
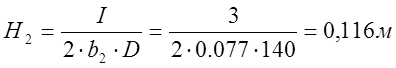
![]() , где
, где![]() масса
растворимого анода после опыта,
масса
растворимого анода после опыта,
![]() ,
,
где ![]() масса нерастворимого анода после
опыта.
масса нерастворимого анода после
опыта.
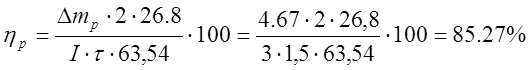
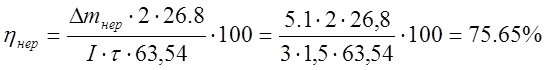
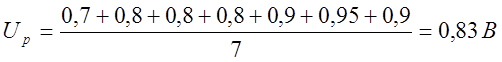
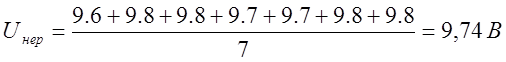
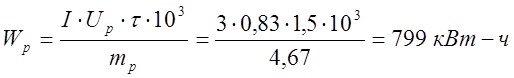
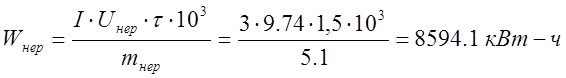
В результате того, что электролиз проводился в лабораторных условиях, не удалось реализовать тех оптимальных условий (циркуляция электролита, поддержание его постоянной оптимальной температуры и т.п.), которые осуществляются при проведении данных процессов в промышленных масштабах, что, безусловно, отрицательно сказалось на результатах. Выходе по току меди получился несколько ниже, чем на предприятиях. Постепенное изменение напряжения в сторону постепенного увеличения негативно отразилось на расходе электроэнергии.
Выход по току растворимого анода составил 85,27%, при 799 кВт-ч затраченной энергии, а у нерастворимого анода выход по току составил 75,65%, при затраченной энергии в 21 раз больше, чем у растворимого анода- 8594,1 кВт-ч.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.