Федеральное агентство по образованию
Государственное учреждение профессионального высшего образования
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)
Кафедра общей и физической химии
РЕФЕРАТ
ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
Выполнил студент гр. ЭП-04 ___________________ /Федотов А.А./
(подпись) (Ф.И.О.)
Проверил доц. ___________________ /Чиркст Д.Э./
(подпись) (Ф.И.О.)
Санкт-Петербург
2004
ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
Теория была предложена в 1929-1932 гг. X. А. Бете и Дж. Ван Флеком. Ион рассматривается в окружении своих лигандов. Название теории связано с тем, что в ней подход к молекуле аналогичен подходу к кристаллической решетке. Эта теория логически продолжила электростатическую теорию. Все взаимодействия здесь изучаются как ион-ионные или ион-дипольные, но с учетом электронного строения центрального иона, структуры комплекса и взаимодействия различных орбиталей с лигандами.
Возьмем
октаэдрический комплекс, в центре которого находится ион или атом какого-либо d-элемента, а в вершинах — анионы или диполи, обращенные к
центру отрицательным полюсом (рис. 1). Известно, что в свободном атоме или ионе
энергетические уровни всех пяти d-орбиталей
одинаковы. В октаэдрическом поле лигандов вырождение снимается. Это связано с
тем, что орбитали ![]() и
и ![]() ,
обозначаемые
,
обозначаемые ![]() , вытянуты в направлении лигандов и
благодаря их взаимному отталкиванию энергия орбиталей становится выше ее уровня
в свободном ионе. Орбитали
, вытянуты в направлении лигандов и
благодаря их взаимному отталкиванию энергия орбиталей становится выше ее уровня
в свободном ионе. Орбитали ![]() ,
,![]() и
и
![]() , обозначаемые
, обозначаемые ![]() ,
наоборот, расположены между лигандами и поэтому обладают меньшей, чем свободный
ион энергией (рис. 2, а).
,
наоборот, расположены между лигандами и поэтому обладают меньшей, чем свободный
ион энергией (рис. 2, а).
При
тетраэдрическом окружении, наоборот, орбитали ![]() обладают
более низкой, а
обладают
более низкой, а ![]() — более высокой энергией, чем в
свободном ионе (рис. 2, б). Расщепление
— более высокой энергией, чем в
свободном ионе (рис. 2, б). Расщепление
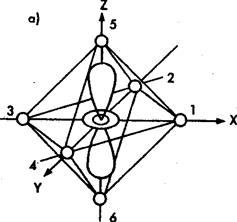
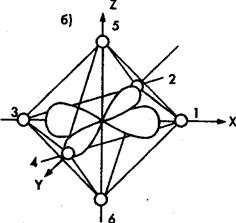
Рис. 1. Орбитали ![]() (а) и
(а) и ![]() (б) в октаэдрическом поле лигандов
(б) в октаэдрическом поле лигандов
∆ в тетраэдрическом окружении составляет 4/9 ее величины в октаэдрическом поле. Его определяют экспериментально по спектрам поглощения комплексов или рассчитывают теоретически методами квантовой химии.
Расщепление
d-орбиталей в комплексах хорошо
объясняет спектральные особенности, и в частности, окраску d-комплексов. Дело в том, что при неполном
заполнении подуровней ![]() и
и ![]() появляется возможность перехода электронов с нижнего уровня
на верхний, что сопровождается поглощением соответствующего кванта энергии в
спектре и изменением окраски комплекса, если это поглощение происходит в
видимой части спектра. Если ионы имеют все 10 d-электронов, такие переходы невозможны. Поэтому ионы Сu+, Аg+, Zn2+, Сd2+, Нg2+ с электронной конфигурацией d10 бесцветны. Потеря еще одного
электрона ионом Сu+ и переход его в Сu2+ сопровождается появлением глубокого
синего цвета.
появляется возможность перехода электронов с нижнего уровня
на верхний, что сопровождается поглощением соответствующего кванта энергии в
спектре и изменением окраски комплекса, если это поглощение происходит в
видимой части спектра. Если ионы имеют все 10 d-электронов, такие переходы невозможны. Поэтому ионы Сu+, Аg+, Zn2+, Сd2+, Нg2+ с электронной конфигурацией d10 бесцветны. Потеря еще одного
электрона ионом Сu+ и переход его в Сu2+ сопровождается появлением глубокого
синего цвета.
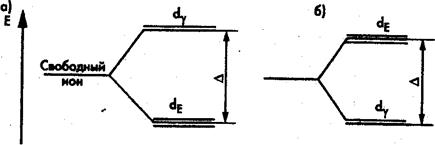
Рис. 2. Расщепление энергетических уровней d-электронов
в октаэдрическом (а) и тетраэдрическом (б) полях лигандов
По величине расщепления ∆ все лиганды располагаются в следующий спектрохимический ряд:
![]() >
>![]() >en>
>en>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]()
Замена лигандов приводит к изменению цвета закомплексованного иона.
Например, при смене лиганда L
окраска медного комплекса [![]() ] изменяется от зеленого при L =
] изменяется от зеленого при L = ![]() , через голубой при L = Н2Oк интенсивно синему при L=NНз, в точном соответствии со
спектрохимическим рядом.
, через голубой при L = Н2Oк интенсивно синему при L=NНз, в точном соответствии со
спектрохимическим рядом.
Теория кристаллического поля смогла объяснить также магнитные
свойства комплексов, которые вызваны наличием в них неспаренных электронов.
Комплексы, обладающие неспаренными электронами и, следовательно, магнитным
моментом, называются высокоспиновыми, а не обладающие магнитными свойствами — низкоспиновыми.
Согласно теории, в пределах одной группы орбиталей ![]() или
или ![]() электроны располагаются в полном
соответствии с правилом Хунда, сообщая комплексу максимальный спин. Поэтому
ионы с электронной конфигурацией d1, d2, d3 (Sс2+, Тi2+, Сr3+) в октаэдрическом поле —
высокоспиновые. Четвертый электрон (например, в ионах Сr2+ или Мn4+), попадая в вон, может заполнить
одну из ячеек нижнего уровня (
электроны располагаются в полном
соответствии с правилом Хунда, сообщая комплексу максимальный спин. Поэтому
ионы с электронной конфигурацией d1, d2, d3 (Sс2+, Тi2+, Сr3+) в октаэдрическом поле —
высокоспиновые. Четвертый электрон (например, в ионах Сr2+ или Мn4+), попадая в вон, может заполнить
одну из ячеек нижнего уровня (![]() в октаэдрическом поле) или занять вакантную ячейку (
в октаэдрическом поле) или занять вакантную ячейку (![]() ) более высокого уровня. Обе
возможности связаны с затратами энергии. Энергия «спаривания» электронов и обычно
определяется квантово-химическими расчетами. Если U >∆, электрон предпочитает занять более
высокую орбиталь
) более высокого уровня. Обе
возможности связаны с затратами энергии. Энергия «спаривания» электронов и обычно
определяется квантово-химическими расчетами. Если U >∆, электрон предпочитает занять более
высокую орбиталь ![]() и тем самым увеличить спин комплекса, если U <∆ , электрон вдет на уже занятую электроном орбиталь и снижает общий спин.
Например, для комплексного иона Fе2+
с конфигурацией d6U=210 кДж/моль, ∆ (Н2O)=124 кДж/моль, ∆ (
и тем самым увеличить спин комплекса, если U <∆ , электрон вдет на уже занятую электроном орбиталь и снижает общий спин.
Например, для комплексного иона Fе2+
с конфигурацией d6U=210 кДж/моль, ∆ (Н2O)=124 кДж/моль, ∆ (![]() ) = 397 кДж/моль. Поэтому комплекс [Fе (Н2O)6]2+ — высокоспиновый, а [Fе(СN)6]4
- - низкоспиновый. В ионе [Fе (СN)6]4 - все
электроны находятся на «связывающих» орбиталях
) = 397 кДж/моль. Поэтому комплекс [Fе (Н2O)6]2+ — высокоспиновый, а [Fе(СN)6]4
- - низкоспиновый. В ионе [Fе (СN)6]4 - все
электроны находятся на «связывающих» орбиталях ![]() в отличие от иона [Fе (Н2O)6]2+ поэтому
прочность связи и химическая устойчивость цианидного иона должна быть много
выше, чем аквоиона, что и наблюдается на практике.
в отличие от иона [Fе (Н2O)6]2+ поэтому
прочность связи и химическая устойчивость цианидного иона должна быть много
выше, чем аквоиона, что и наблюдается на практике.
Отсутствие
электронов на «разрыхляющих» орбиталях ![]() обычно приводит к упрочнению комплекса или даже к
изменению его конфигурации. В ионе Сu2+, имеющем
конфигурацию d9, не хватает одного электрона на «разрыхляющей»
орбитали
обычно приводит к упрочнению комплекса или даже к
изменению его конфигурации. В ионе Сu2+, имеющем
конфигурацию d9, не хватает одного электрона на «разрыхляющей»
орбитали ![]() что усиливает связь с четырьмя лигандами, находящимися в
плоскости XY.
что усиливает связь с четырьмя лигандами, находящимися в
плоскости XY.
Поэтому для этого иона весьма характерно плоское строение комплексов с КЧ=4 (квадрат с центральным ионом Сu2+).
Таким образом, теория кристаллического поля охватывает гораздо большую совокупность физико-химических свойств, чем электростатическая теория Косселя-Магнуса. Однако и эта теория, также основанная на чисто электростатических представлениях, не позволяет объяснить свойства комплексов металлов с неполярными лигандами, например СО, C6H6, С5H5 и т. д., рассчитать энергии связи, волновые функции и другие параметры химических связей, предсказать структуру комплекса, особенно в случаях, когда КЧ отличается от 4 и 6.
ИПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Дибров И. А.
Неорганическая химия. СПб.: «Лань», 2001. (Учебник для вузов. Специальная литература).
2. Лекции. - Чиркст Д. Э.
Федеральное агентство по образованию
Государственное учреждение профессионального высшего образования
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)
Кафедра общей и физической химии
РЕФЕРАТ
РАЗЛИЧИЕ ГЕОМЕТРИИ МОЛЕКУЛ ДИОКСИДА
УГЛЕРОДА И ДИОКСИДА СЕРЫ
Выполнил студент гр. ЭП-04 ___________________ /Федотов А.А./
(подпись) (Ф.И.О.)
Проверил доц. ___________________ /Чиркст Д.Э./
(подпись) (Ф.И.О.)
Санкт-Петербург
2004
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.