





















Министерство образования Российской Федерации
Санкт-Петербургский государственный горный институт
им. Г.В. Плеханова
(технический университет)
Кафедра металлургии цветных металлов
МЕТОДЫ КОНТРОЛЯ И АНАЛИЗА ВЕЩЕСТВ
Лабораторные работы
Составитель доц. Зайцев Ю.А.
2001
В объемном количественном анализе в настоящее время широко используются реакции комплексообразования, связанные с взаимодействием ионов металлов с аминополикарбоновыми кислотами и их солями. Эти соединения, предложенные в 1945 году для аналитических целей швейцарским химиком Г.Шварценбахом, получили название комплексонов. Комплексоны образуют прочные, растворимые в воде внутрикомплексные соединения с ионами очень многих металлов, в том числе даже с ионами щелочноземельных металлов: магнием, кальцием и барием, которые, как известно, весьма трудно связываются в комплексы. При этом комплексоны могут использоваться в качестве титрующего реагента (титранта), так как:
1) реакция комплексообразования протекает быстро;
2) образуется комплекс постоянного стехиометрического состава;
3) эквивалентная точка достигается без избытка реактива;
4) найдены соответствующие индикаторы для наблюдения эквивалентной точки.
Наибольшее практическое значение из комплексонов имеют этилендиаминтетрауксусная кислота (ЭДТУК) и ее двунатриевая соль, которая получила названия комплексон III, трилон Б или ЭДТА:
![]()
![]()
![]() СН2СООNа
СН2СООNа
СН2-N
![]()
![]() СН2СООН
СН2СООН
× 2Н2О ( Nа2 С10Н14О8N2•2Н2О)
СН2СООН М= 372,24
СН2-N
СН2СООNа
Сокращенно трилон Б можно представить формулой Nа2Н2Y, где Y - анион этилендиаминтетрауксусной кислоты.
Трилон Б - белый мелкокристаллический порошок, хорошо растворимый в воде и в растворах щелочей. При взаимодействии раствора трилона Б с ионами металлов-комплексообразователей металл замещает атомы водорода карбоксильных групп -СООН и одновременно связывается координационной связью с атомами азота:
СН2СООNа СН2СООNа
![]()
![]()
![]()
![]()
![]() СН2-N
СН2-N
СН2-N
СН2-N
СН2СООН СН2СОО
![]() +
Ме2+ Ме + 2Н+
+
Ме2+ Ме + 2Н+
![]()
![]()
![]()
![]()
![]() СН2СООН СН2СОО
СН2СООН СН2СОО
![]()
![]()
![]()
![]() СН2-N
СН2-N
СН2-N
СН2-N
СН2СООNа СН2СООNа
или
![]()
![]() Nа2Н2Y
2Nа+ + Н2Y2-
Nа2Н2Y
2Nа+ + Н2Y2-
![]()
![]() Ме2+ + Н2Y2- МеY2- + 2Н+
Ме2+ + Н2Y2- МеY2- + 2Н+
Для катионов трех- и четырехвалентных металлов реакции взаимодействия с трилоном Б можно представить в следующем виде:
![]() Ме3+
+ Н2Y2- МеY- + 2H+
Ме3+
+ Н2Y2- МеY- + 2H+
![]() Ме4+
Н2Y2- МеY + 2Н+
Ме4+
Н2Y2- МеY + 2Н+
Согласно приведенным уравнениям реакций 1 г-ион реагирующих с трилоном Б катионов металлов, независимо от их валентности связывает 1 г-моль трилона Б. Кроме того, реакция комплексообразования сопровождается выделением ионов водорода в количестве, эквивалентном количеству определяемого металла (2 г-иона водорода на 1 г-ион металла).
Рассчитаем, с каким количеством металла взаимодействует 1 мл децинормального (0,1 N) раствора трилона Б.
Поскольку трилон Б - двузамещенная соль ЭДТУК, которая содержит два замещаемых атома водорода (Nа2Н2Y), то 1 мл его 0,1 N раствора содержит трилона Б
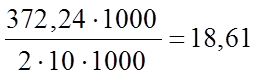 МГ
МГ
При взаимодействии 1 моль трилона Б (372,24 г) оттитровывает 1 г-атом металла, следовательно, 18,61 мг трилона Б оттитруют
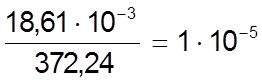 г-атома
металла, или
г-атома
металла, или
0,05 мг-атома металла, независимо от его валентности.
Исходя из этого, рассчитаем титры децинормального раствора трилона Б при комплексонометричеком титровании некоторых металлов:
Zn AZn = 65,37 TZn0,1N трил.Б = 65,37×0,05 = 3,27 мг/мл или
0,00327 г/мл
Сd ACd = 112,4 ТСd0,1N трил.Б = 112,4×0,05 = 5,62 мг/мл
Са АСа = 40,08 ТСа0,1N трил.Б = 40,08×0,05 = 2,0 мг/мл
Мg АМg = 24,31 ТМg0,1N трил.Б = 24,31×0,05 = 1,22 мг/мл
Al AAl = 26,98 ТAl0,1N трил.Б = 26,98×0,05 = 1,35 мг/мл
Образующиеся комплексные соединения трилона Б с металлами очень прочные, что видно из следующих значений констант устойчивости комплексов некоторых металлов (приведены значения десятичных логарифмов констант).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.