При поглощении аммиака серной кислотой образуется раствор сульфата аммония, который перерабатывается в твердую соль – удобрение. При поглощении аммиака происходит значительная конденсация из газа паров воды.
Абсорбция HCN производится под давлением 7 атм водой в абсорберах тарельчатого типа, а оставшийся газ, содержащий N2, H2, CO, остатки HCN, направляется в топки паровых котлов. Водный раствор синильной кислоты подвергается дистилляции. Отгонная синильная кислота охлаждается и конденсируется. После добавления 0,1-0,2 % фосфорной кислоты она направляется на склад.
Второй метод извлечения синильной кислоты из газов основан на одновременном поглощении аммиака и синильной кислоты раствором пентаэритритбората (кислый эфир борной кислоты) с образованием аммонийной соли пентаэритритбората:
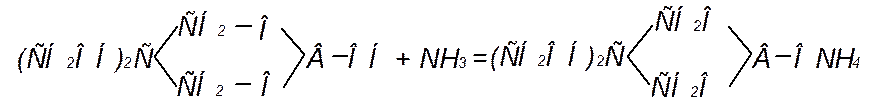
Одновременно водным раствором поглощается цианистый водород.
Схема установки для производства синильной кислоты с регенерацией непрореагировавшего аммиака приведена на рис. 7.1.
Аммиак, природный газ и воздух после фильтров 1 и смесителя 3 поступают в контактный аппарат 4. Полученный после контактирования газ, содержащий цианистый водород, быстро охлаждается в паровом котле 5, расположенном непосредственно под контактным аппаратом. Затем газы поступают в абсорбер 7, орошаемый 8%-м водным раствором пентаэритритбората (2,5 % борной кислоты). Аммиак связывается с пентаэритритборатом, а цианистый водород растворяется в воде. Тепло реакций и газа отводится через холодильник водой. Далее газы поступают на сжигание, а раствор идет через подогреватель 9 в десорбер 10.
Десорбер работает при 88ºС и разряжении 250 мм рт.ст. Необходимое тепло подводится через кипятильник 12. Выделяющиеся пары HCN поступают через холодильник 11 в промывную колонну 19, где промываются серной кислотой от влаги и остатков аммиака и затем подвергаются охлаждению и конденсации в виде 99 %-й HCN.
Насыщенный аммиаком раствор пентаэритритбората поступает через теплообменник 13 в отгонную колонну 14. Здесь при температуре 132ºС и давлении 1,17 МПа отгоняется аммиак и реакционная вода. Подвод тепла осуществляется с помощью кипятильника 15. Регенерированный раствор поступает через кипятильники 13 и 9 и холодильник 8 снова в абсорбер 7.
Смесь паров аммиака и паров воды из колонны 14 охлаждается в кипятильнике 12 и холодильнике 16. Далее из раствора в отгонной колонне (14) при 150ºС и 0,35 МПа отгоняется аммиак, который вместе с аммиаком, выделившимся в колонне 16, поступает снова в цикл.
Расходные коэффициенты на получение 1 т синильной кислоты следующие:
Аммиака 0,85 т,
Метан 1700 м3,
Пар 1,8 т,
Электроэнергия 300 квт∙час,
Вода 470 м3.
7.2. Производство концентрированной азотной кислоты
В настоящее время единственным промышленным способом получения азотной кислоты является каталитическое окисление аммиака кислородом воздуха с последующим поглощением оксидов азота водой.
Физико-химические основы процесса
1. Окисление аммиака в оксиды азота.
В зависимости от условий проведения процесса окисления на катализаторах возможно протекание следующих реакций:
4NH3+5O2 = 4NO+6H2O+904 кДж (7.13)
4NH3+4O2 = 2N2O+6H2O+1104,4 кДж (7.14)
4NH3+3O2 = 2N2+6H2O+1268,8 кДж (7.15)
Одновременно возможны и другие параллельные реакции продуктами которых является молекулярный азот, например взаимодействие оксида азота (II) с аммиаком:
4NH3 + 6NO = 5N2 + 6H2O+ 1810,6 кДж (7.16)
диссоциация оксида азота (II) и аммиака:
2NO = N2 + O2+ 180,6 кДж (7.17)
2NH3 = N2 + 3H2– 291,6 кДж (7.18)
Величины констант равновесия Кр реакций (7.13-7.15) при температуре 900ºС составляют:
Кр(1)=10-53; Кр(2)=10-61; Кр(3)=10-67.
Практически все они могут считаться необратимыми. При гомогенном окислении аммиака наибольшую термодинамическую вероятность имеет реакция (7.15). Поэтому при поджигании факела аммиака на воздухе он горит с образованием молекулярного азота. Для получения целевого продукта – оксида азота (II) – необходим селективный катализатор.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.