II. Растворимые Аноды. Электроны в цепь посылает сам анод, а не анеоны раствора, при этом анод растворяется.
…
Законы Фарадея. 1. Масса образующегося при электролизе вещества пропорционально кол-ву прошедшего через раствор электричества. m=kq, k-эл.-химический эквивалент.
2. При электролизе разл. хим. соединений равный кол-ву электричества приводит к Эл-хим. превращению эквивалентных кол-ву веществ.
k=mэ/F; q=I*t
|
m=mэ*I*t/F |
формула Фарадея. F-число фарадея. F=96500Кл/м
Физич. смысл: это кол-во электричества необходимое для одного моля вещ-ва.
Строение атома.
Атом- это электронейтральная система, состоящая из + заряж. ядра и – заряж. электронов вне ядра.
Электрон: q=-1, масса в а.е.м.=0,000549.
протон: q=1, масса=1
нейтрон: q=0, масса=1.
A=Z+N. N-число Эл. A-массовое число, Z-число протонов.
Изотопы- это атом имеющий
один заряд ядра и разные массы. ![]()
![]()
![]()
Изобары- это атомы имеющие одно массовое число и разный заряд ядра.
Квантовая механика. В основу легли представления о двойственных в природе электрона. Электрон одновременно явл. как материальной частицей и волной. Частица: обладает массой, зарядом, собственный момент вращения. Волна: дифракция, интерференция, нелокализованность в пространстве.
Принцип Гейзенберга: Нельзя одновременно с дост. точностью опред. координаты частицы и её скорость. Чем точнее координаты тем менее точно опред. скорость, импульс.
Волновая функция электрона. ![]() (пси).
(пси). ![]() -
этоамплитуда колебания волны.
-
этоамплитуда колебания волны.
Атомная орбиталь- это пространство с наибольшей вероятностью нахожд. электрона.
Уравнение Шрёдингера.
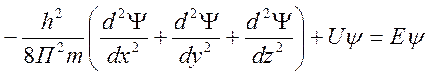 - связывает
энергию электрона с пространственными координатами. U-пот.
энергия, E-полная энергия,
- связывает
энергию электрона с пространственными координатами. U-пот.
энергия, E-полная энергия, ![]() волновая
функция.
волновая
функция.
Что даёт уравн. Шрёдингера?
1) Находим волновую функцию от координат. 2) Находим знач. энергии электрона.
Знач. Энергии зависит от 3-х величин.
1) n-гл. квантовое число. Характеризует общий запас электрона на опред. энергетическом уровне, а так же размер Эл. облака. Его знач. n=1,2,3,4… и опред. буквами KLMN.
2) l-побочное квантовое число (орбитальное). Характеризует энергию электрона на подуровне и форму Эл. облака. Принимает знач. от 0 до (n-1). s,,p,d,f.
3) me-магнитное квантовое число. Хаар. энергию электрона на орбитали и простр. ориентацию.
Кол-во орбиталей –(2l+1)
me=-l…..l
Атомная орбиталь- это совокупность положения электронов в атоме характеризуемая опред. значениями 3-х атомных чисел.
Принцип (запрет) Паули: - В любой многоэлектронной системе не может быть двух электронов у которых все их квантовые числа были бы одинаковы.
Следствие: 1) Макс. число Эл. на уровне xn=2n2
2)макс. число на
подуровне. xe=2(2![]() +1)
+1)
3) макс. кол-во Эл. на орбитали.
Правило Гунда: В главном подуровне эл. стремятся занять максимльное число свободных орбиталей, чтобы суммарное спиновое число было максимальное.
Распределение эл. в атоме. Правило Клечковского. Распределение эл. по эровням и подуровням подчин. требованиям минимума энергии.
Реалный
порядок отличается тем, что в связи с движ. электронных уровней где много
эл. атомоврезко увелич. зависимость энергии не только от n но и ![]() . И порядок заполнения
электронов опред. суммой (n+
. И порядок заполнения
электронов опред. суммой (n+![]() ) в
соответствии с правилами Клечковского. 1) При увелич. номера элемента послед.
заполнения электронами орбитали происходит от орбитали с меньшим знач. (n+
) в
соответствии с правилами Клечковского. 1) При увелич. номера элемента послед.
заполнения электронами орбитали происходит от орбитали с меньшим знач. (n+![]() ) к орбит. с большим знач. (n+
) к орбит. с большим знач. (n+![]() ) к орбитали с большим знач. (n+
) к орбитали с большим знач. (n+![]() ).
).
2) если (n+![]() ) для 2-х орбит. одинаковы заполн. сначала
орбиталь с меньшим значением n.
) для 2-х орбит. одинаковы заполн. сначала
орбиталь с меньшим значением n.
Реальный порядок заполнения: 1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.