![]()
Гомогенные процессы – система, сост. из одной фазы. Гетерогенные – сист., сост. из нескольких фаз (вода – лед). Фаза – совокупность всех одинаковых частей системы, обладающих одинак. хим. сост. и св. и отдельных от других частей системы поверхностью раздела.
В гомогенной сист. Реакция протекает во всем объеме, а в гетерогенных на поверхности раздела фаз.
Скорость хим. реакции- назыв. изменение концентрации
реагир. веществ или продуктов реакции в единицу времени. 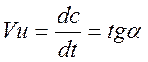
Зависимость скорости реакции от разл. факторов: 1) Природа и сост. реагир. веществ. Большую роль играют межмолекулярные и внутримолекулярные силы взаимодействия. а)агрегатное сост. б) гетероганная реакция-V реакции будет зависить от Sпов.
2) Концентрации реагир. веществ. закон действия масс: При постоянной температуре V хим. реакции пропорциональна произведению концентрации реагир. веществ в степени равной стехеометрическому коэффиц. уравнений реакций. H2+Y2=2HY
V=k[H2]*[Y2]
k-константа скорости- это скорость реакции при единичной концентрации (1моль*л) реагир. вещ-в.
Особенность гетерогенной раекции- концентрация твердых вещ-в не учитывается.
3) Температура. Правило Вант-Гоффа: при увел. температуры на каждые 10 градусов скорость хим. реакции увел. в 2-4 раза.
V2=V1*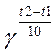 ;
; 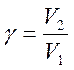
Уравнение Аррениуса. 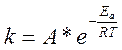 ;
A- предельный экспоненциальный множитель;
;
A- предельный экспоненциальный множитель;
4) Наличие и природа катализатора. Катализ-изменение V под действием катализатора.
Химическое равновесие. Обратисые реакции-реакции, протекающие при тех же условиях в прямом и обратном направлении.
Смещение. Принцип Ле-шателье. Если на сист. наход. в равновесии оказать какое либо воздействие то она сместится в сторону уменьшения оказанного воздействия.
1. Изм. концентрации. Увелич. конц. одного из компонентов смещает равновесие в сторону переработки этого компонента.
![]() ;
; ![]()
![]()
![]()
2. Температура. Повышение температуры смещает равновесие в сторону эндотермич. реакции.
![]()
![]()
3. Давление. Увелич. давления смещает. процесс в сторону уменьшения обьёма (числа молекул).
![]()
![]()
![]()
ОВР – реакции, в которых происходит смещение или полный переход электронов от одних атомов, ионов, молекул к другим, в результате чего изменяется степень окисления атомов реагирующих частиц. Окислители – вещества, которые могут принимать электрон от других веществ (восстановление). Электроны при образовании хим. связи смещаются к более электроотрицат. Степень окисления –число электронов смещ. от одного элемента к другому.
Окислители: 1. галогены 2.кислоты 3. э. высшей степени окисления
Восстановители:1.H ,CO, C 2. Na, K, Mg, Al, Mn 3. Элементы нисшей степени окисления
Составление уравнений: 1. Опред. степень окисления всех элементов учавств. в реакции. 2. Опред. элементы меняющие степень окисления. 3. Составляем электронный баланс при этом сумма электронов отдаваемые всеми вост. равна сумме электронов принимаемых всеми окислителями. 4. Определяем коэф. реакции и расставляем их в реакцию. 5. Сводим баланс по металлам. 6. В кислой среде сводим баланс по кислым остаткам. 7. Сводим баланс по водороду. 8. Проверяем баланс по кислороду.
![]()
Химические св-ва металлов. это элементы обладающие с ярко выраженной способностью отдавать при химическом взаимодействии с образованием положит. заряж. ионов. Me0 – n e = Men+
Взаимодействия с металлами: 1) С водой. Реагируют
только реактивные металлы (щелочные и щелочно-земельные, Al
реагир. только при особых условиях.) ![]()
2) Взаимодействия с щелочами. Взаимодействуют амфотерные металлы. (Zn,Al,Be,Sn,Sb,Cr,Mn)
![]()
3) Взаимодействие с кислотами. Реагируют все металлы стоящие в ряду активности до H2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.