Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
Высшего профессионального образования
Новосибирский Государственный Технический Университет
Кафедра: ИПЭ

КУРСОВОЙ ПРОЕКТ
По дисциплине «Каталитические методы защиты окружающей среды»
Тема: Хлорорганические соединения
Выполнил: Преподаватель:
Факультет: ЛА Ведягин А. А.
Группа: СЭМ - 81
Студент: Кравчук Ирина
Новосибирск
2012
Обзор литературы
Физико–химические свойства
Токсикологические свойства
Источники поступления в окружающую среду
Существующие методы утилизации
Термодинамический расчёт реакции
Необходимо провести термодинамический расчёт данной химической реакции:
С2H4Cl2
+
2H2 ![]() С2H6
+ 2HCl.
С2H6
+ 2HCl.
Константу равновесия данной реакции можно рассчитать двумя способами:
1) Через концентрации исходных веществ и продуктов реакции;
2) Через Энергию Гиббса реакции.
1)
Кр = 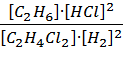 . Для удобства запишем исходную
реакцию в следующем виде:
. Для удобства запишем исходную
реакцию в следующем виде:
A + 2B = C + 2D, тогда константа равновесия примет вид:
Кр = 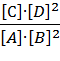 .
.
2)
Кр
= 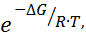 где
где ![]() энергия Гиббса, равная
алгебраической сумме энергий продуктов реакции за вычетом энергии исходных
веществ.
энергия Гиббса, равная
алгебраической сумме энергий продуктов реакции за вычетом энергии исходных
веществ.
![]() =
= ![]() (С2H6)
+
(С2H6)
+
![]() (HCl)
-
(HCl)
- ![]() (С2H4Cl2)
-
(С2H4Cl2)
- ![]() (H2).
(H2).
![]() = - 94,79 – 32,89 + 80,33 + 0 = -
47,35.
= - 94,79 – 32,89 + 80,33 + 0 = -
47,35.
![]() – универсальная
газовая постоянная. R
= 8,314.
– универсальная
газовая постоянная. R
= 8,314.
![]() –
температура, при которой проходит реакция. T
= 293 К.
–
температура, при которой проходит реакция. T
= 293 К.
Таким образом, константа равновесия данной реакции будет равна:
Кр = 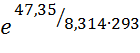 = 1,01 ≈ 1.
= 1,01 ≈ 1.
Поскольку первоначально мы имели1 моль дихлорэтана и 2 моль водорода, а в результате реакции получили 1 долю метана и две доли хлороводорода, то долю этана в продуктах реакции представим, как неизвестную величину x, тогда доля хлороводорода будет равна 2x. В начальный момент времени. до того, как исходные вещества прореагировали:
|
В момент времени τ, когда исходные вещества прореагировали, получаем:
|
Выразим концентрацию каждого вещества следующим образом:
ωA
= ![]() ; ωC
=
; ωC
= ![]() ;
;
ωB
=
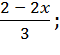 ωD
=
ωD
= ![]() .
.
Кр = 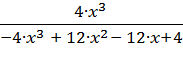 1.
1.
Получаем следующее кубическое уравнение:
![]() = 0.
= 0.
А Кр куда делось?
Можно сразу писать корень…
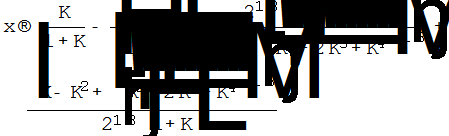
В данном случае К – это Кр
Тут мы пришли в тупик.
Кубическое уравнение простым подбором корней и разложением не решается.
Вопрос: можно ли решить полученное уравнение при помощи вычислительных программ и, не писав, как мы это делали (то есть как находили корни), написать ОТВЕТ???
Выводы
Список литературы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.