Вследствие обратимости процессов сорбции их целесообразно использовать для очистки сточных вод от примесей, которые можно использовать повторно в технологическом процессе.
Данные методы очистки сточных вод находят применение практически в любых отраслях промышленности для очистки от многих примесей, в том числе и шестивалентного хрома. Эти методы позволяют обеспечить высокую эффективность очистки, а также получать выделенные из сточной воды металлы в виде относительно чистых и концентрированных солей.
Для ионообменной очистки сточных вод используют синтетические ионообменные смолы.
Рассматриваемые нами сточные воды содержат ионы меди, цинка и хлора. Следовательно, данные ионы содержатся в воде в виде растворов солей – хлоридов меди и цинка.
Метод нейтрализации не может быть использован, поскольку при применении данного метода может образоваться большое количество побочных, ненужных нам соединений.
Окислительно-восстановительные метода так же не применимы в данной ситуации, поскольку окисление не может быть применено (все ионы уже окислены), восстановление же в принципе не возможно, так как необходимо значение рН в растворе равное 2.
Очистка сточных вод такого состава осуществляется преимущественно осадительными способами (реагентными) - переводом катионов металлов в малорастворимые в воде соединения с помощью тех или иных реагентов. Чаще всего используется осаждение катионов металлов в виде их гидроксидов с помощью щелочных реагентов.
Преимуществом реагентного метода является высокая степень сточных вод от тяжёлых металлов (до ПДК), также простота эксплуатации оборудования.
Недостатки: образование значительного количества трудно перерабатываемого шлама, также существенный расход реагентов и в связи с этим необходимость реализации реагентного хозяйства.
Очищенная данным методом вода содержит значительное количество солей и может быть использована в оборотах сельскохозяйственного водоснабжения лишь после дополнительной очистки.
Рассмотрим технологическую схему реагентной очистки (см. рис. 1).
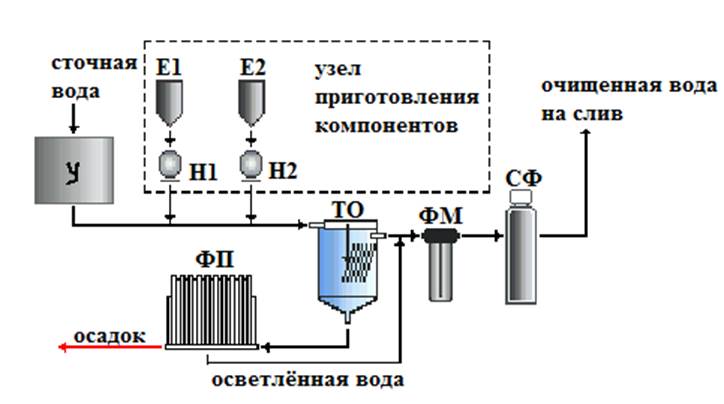
Рисунок 1 – Технологическая схема очистки сточных вод гальванических цехов машиностроения [6].
На данной схеме представлено: У – усреднитель разбавленных и концентрированных стоков, к который поступают загрязнённые сточные воды; Е1 и Е2 – ёмкости для приготовления необходимых реагентов, в зависимости от состава сточной воды; Н1 и Н2 – дозирующие насосы, через которые происходит подача необходимого количества реагентов в сточную воду; ТО – отстойник с тонкослойным модулем; ФМ – фильтр механический мешочного типа; СФ – сорбционный фильтр со специальной загрузкой или ионообменной смолой для очистки от тяжёлых металлов; ФП – фильтр-пресс для обезвоживания осадка.
Установка обеспечивает очистку сточных вод до норм ПДК для слива в канализацию. Производительность 1-25 м³/час. Степень очистки от солей тяжелых металлов - до 99,5 %.
Следовательно, концентрация ионов меди и цинка в очищенной сточной воде равна соответственно: 0,005∙30,4 = 0,152 мг/л и 0,005∙30 = 0,15 мг/л (что соответствует ПДК – см. табл. 1).
В гальваническом производстве сточные воды содержат ионы меди и цинка в составе солей: CuSO4 - сульфат меди и ZnSO4 - сульфат цинка.
Гидроксиды, карбонаты и сульфиды цинка и меди являются нерастворимыми веществами, следовательно, для того, чтобы определить необходимый реагент, рассчитаем произведение растворимости получаемых веществ.
ПР (СuСО3) = 2,5∙10-10;
ПР (Zn СО3) = 1,45∙10-11;
ПР (Сu(OH)2) = 5,6∙10-20;
ПР (Zn(OH)2) = 3,0∙10-16;
ПР (CuS) = 1,4∙10-36;
ПР (ZnS) = 7,9∙10-24.
Так как произведение растворимости сульфидов и карбонатов меди и цинка меньше произведений растворимости их гидроксидов, то в качестве реагента можно взять Na2S сульфид натрия.
Запишем полученные реакции:
CuСl2 + Na2S → CuS↓ + NaCl
ZnСl2 + Na2S → ZnS↓ + NaCl
Так как рН сточной воды равна 7,8, то необходимо знать значение рН раствора, которая соответствует началу и концу осаждения данных гидроксидов, табл. 2.
Таблица 2 – рН осаждения ионов меди и цинка.
|
Катион металла |
Величина рН, соответствующая |
|
|
Началу образования гидроксида |
Концу образования гидроксида |
|
|
Cu2+ |
5,5 |
9,3 |
|
Zn2+ |
6,4 |
8,0 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.